نشر فريق بحثيّ أميركي في 6 يناير/ كانون الثاني الماضي، ورقةً علميةً في دورية نيتشر؛ تمثّل حدثاً بارزاً في العلاج الوراثي عبر تقنية كريسبر.
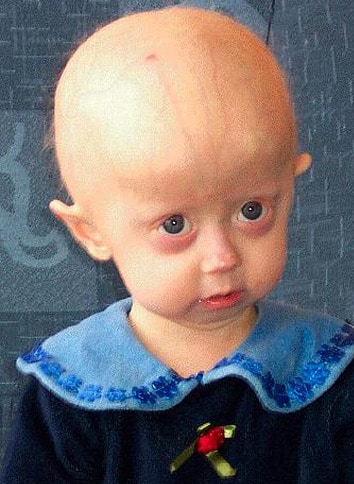
تعاوَنَ «فرانسيس كولينز»؛ رئيس وكالة المعاهد الوطنية الأميركية للصحة، ومجموعة من الباحثين، مع «ديفيد ليو»؛ أستاذ في جامعة هارفارد، لمحاولة علاج «الشيخوخة المبكّرة» (البروجيريا) أو «متلازمة جيلفورد-هاتشينسون»؛ وهو اضطراب وراثي يجعل الأطفال المصابين يتقدمون بالعمر بشكلٍ سريع.
نتائج هذا التعاون في الدراسة؛ التي تم اختبارها بنجاح على الفئران، أصبحت ممكنةً بسبب اختراع ليو لتكنولوجيا سلاسل «كريسبر» للتعديل الوراثي من الجيل الثاني؛ التي تدعى «تعديل الأُسس» (كريسبر هو مصطلح يمثل اختصاراً لعبارة «التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد»؛ وهي سلاسل من الدنا توجد في كائنات مثل بدائيات النوى والعتائِق؛ وبذلك فإن «تكنولوجيا سلاسل كريسبر» هي تكنولوجيا تُستخدَم فيها هذه السلاسل). باستخدام هذه التكنولوجيا، قد يستطيع الباحثون في النهاية علاج الأمراض الوراثية المزمنة عند البشر؛ ومن ضمنها البروجيريا.
مرض نادر ولكن خطير
عمل «فرانسيس كولينز»؛ الرئيس الأسبق لمشروع الجينوم البشري، لسنوات على إيجاد علاج للبروجيريا قبل إجراء البحث الجديد.
الأطفال الذين تحتوي مادتهم الوراثية على الطفرة المسؤولة عن البروجيريا لديهم ذكاء طبيعي، لكنهم يُظهرون أعراضاً مبكّرةً للتقدّم بالعمر؛ تشمل هذه الأعراض فقدان الشعر، وضعف السمع. عندما يصلون إلى سنوات المراهقة، يبدو عليهم أنّهم مسنّون، ولا يعيش الكثير منهم ليتجاوزوا سن الـ 13 عاماً.
في 2003، اكتشف مختبر كولينز أن البروجيريا تنتج عن طفرة؛ وهي خطأ في تسلسل النيوكليوتيدات، في مورّثة مسؤولة عن تركيب بروتين يدعى «لامين إيه»؛ وهو بروتين له وظيفة بنيوية في نوى الخلايا.
تحتوي أجسام العديد منا على طفرات في الكثير من المورّثات، ولكن بما أننا نمتلك نسختين من الجينات عادةً (واحدة من آبائنا والأخرى من أمهاتنا)، فنحن نميل لأن نمتلك نسخةً سليمة؛ وهذا يكفينا عادةً.
لكن الطفرة المسؤولة عن البروجيريا مختلفة؛ إذ أنه على الرغم من وجود نسخة سليمة، إلّا أن النسخة الطّافرة تصنع منتَجاً سامّاً يفسد الأمور؛ هذا النوع من الطفرات يدعى «طفوراً سلبياً مسيطراً».
نظرياً؛ الحل هو تصحيح النسخة الطافرة باستخدام تقنية كريسبر. باستخدام هذه الأداة الوراثية، يستطيع العلماء أن يوجّهوا زوجاً من «المقصّات» الجزيئية داخل أي جزء من الدنا (الحمض النووي)، ولكن لسوء الحظ، لم تمتلك تقنيات كريسبر من الجيل الأول الدقّة الجراحية أو الكفاءة الكافية لتصحيح طفرة بروتين لامين أيه، على الرغم من فعاليتها في تقطيع المورّثات.
مضاعفات متعلّقة بتعديل الخلايا على نطاق واسع
مقصّات كريسبر ذات كفاءة عالية في إيجاد أهدافها وقطعها، ولكن عملية التعافي البنائية التي تلي القَطع تقع على الخلية نفسها؛ وهي عملية ليس من المضمون حدوثها في كل خليّة.
في المختبر، يستطيع الباحثون العمل على تصحيح بعض الخلايا قبل إنمائها في أطباق بِتري، لاستخدامها في أبحاث مستقبلية، ولكن عند البشر، يتعيّن على الباحثين تصحيح معظم الخلايا بدقّة-إن لم يكن كلها. لن يتم علاج البروجيريا إذا صُحّحت طفراتها في 5 خلايا فقط موجودة في إصبع المريض مثلاً، وهنا يلعب اختراع ديفيد ليو دوراً حاسماً.
حدد ليو القيود التي تحصر تكنولوجيا كريسبر مبكراً جداً، وبدأ بتطوير آلات جزيئيّة قادرة على العمل كأكثر من مقصّات جزيئية موجّهة.
بدأ ليو بالعمل على أنزيمات طبيعية قادرة على تبديل نوع من الأسس الكيميائية في الشيفرة الوراثية بنوع آخر. على سبيل المثال، الأنزيمات التي تستطيع تحويل الأساس «أدينين» إلى الأساس «جوانين»، أو تلك التي تحوّل الأساس «سيتوزين» للأساس «ثايمين».
الشكل الحلزوني المزدوج للحمض النووي يحتوي على سلسلة متناوبة من الفوسفات والسكر (على الجوانب). يتصل بكل جزيء سكّر واحدٌ من 4 أسس كيميائية: أدينين (أيه)، ثايمين (تي)، جوانين (جي) وسيتوزين (سي). ترتيب هذه الأسس يحدد الشيفرة الوراثية للكائن.
بعد ذلك، عدّل ليو الأنزيمات ليجعلها أكثر دقّةً، ومزجها مع سلاسل كريسبر ليخلق بروتينات تدعى «مُعدّلات الأسس». بما أن تقنية كريسبر فعّالة في قراءة الحمض النووي وإيجاد الهدف، يمكنها أيضاً إيصال المُعدِّلات بكفاءة إلى المورّثات التي يجب تعديلها.
يجدر الذكر أن ليو طوّر معدّلات الأسس بشكلٍ متعمّد حتّى تكون قادرةً على تعديل الأسس دون أن تقطع الحمض النووي كما تفعل مقصّات كريسبر؛ هذا الأمر حاسم لأن قطع الحمض النووي يزيد خطر أحداث الحذف الصبغيّ التي يمكن أن تضر بالخلايا.
اختلافات بين الفئران والبشر
علم كولينز وليو وزملاؤهما أنهم بحاجة لإيصال مُعدّلات الأساس إلى كل الخلايا (أو على الأقل معظمها) في أجسام الفئران المصابة بالبروجيريا لعلاجها، ولتحقيق ذلك، اعتمدوا على فيروسات مجوّفة كناقلات.
استخدم الباحثون ناقلات مبنيّة على تركيب «الفيروسات المرتبطة بالفيروسات الغُديّة»؛ وهي من أصغر الفيروسات، ولا تتسبب أية أمراض معروفة.
مزج كولينز وليو هذه الأجسام الفيروسية مع المورّثات التي تُركّب الأنزيمات مُعدّلة الأسس، وحقنوها في الفئران. عولجت الفئران التي حُقنت من المرض، وأصبحت مثل الفئران السليمة تماماً.
في هذا الفيديو، يناقش كولينز وليو عملهما المتعلّق بعلاج البروجيريا عند الفئران:
لكن بالطبع، كل هذا حدث عند الفئران فقط، والبشر أكبر بكثير. لا نعلم مدى صعوبة تطبيق آلية التعديل الوراثي هذه على البشر، ولكن في جميع الأحوال، أخذ كولينز وليو خطوةً أولى كبيرة بتبيان أنّها ناجحة عند الفئران.
أدوات التعديل الوراثي المعتمدة على سلاسل كريسبر هي بمثابة حلم يتحقق للخبراء الذين يعملون في العلاج الوراثي، وللعائلات التي يعاني أطفالها من حالات مثل البروجيريا. لا يزال العمل في هذا المجال في مراحله الأولى، ولكن في زمن الجائحة هذا، فإنّه يمنحنا أملاً نحتاجه كثيراً.
هذا المقال محمي بحقوق الملكية الدولية. إن نسخ نص المقال بدون إذن مسبق يُعرض صاحبه للملاحقة القانونية دولياً