تمكن باحثون من قطع شوط مهم جداً في مجال أبحاث داء ألزهايمر، وذلك من خلال دراسة جرى نشر نتائجها مؤخراً في مجلة الطبيعة. فقد استطاع الباحثون رسم النموذج الأول المتكامل لخيط تاو، وهو بنية البروتين الشاذة التي توجد في خلايا دماغ مرضى ألزهايمر، ويُعتقد بأنها سبب الإصابة بهذا الداء التنكسي العصبي.
ويذهب الكثير من العلماء إلى أن بروتينات تاو هي الوحدات الجزيئية الرئيسية في داء ألزهايمر. حيث تتشابك هذه الوحدات مع بعضها وتتجمع بشكل عقد يُعتقد بأنها تُعيق الاتصالات بين الخلايا، وتسبب بالتالي فقدان الذاكرة المرتبط بداء ألزهايمر. ويمكن لاختلاف شكل وترتيب عقد تاو أن يترافق مع أنماط مختلفة من المرض التنكسي العصبي، مثل داء باركنسون.
تُعد هذه الدراسة الأولى التي تنجح في رسم بنية متكاملة لبروتين تاو. فقد وجد الباحثون بأن خيط تاو يتألف في الحقيقة من جزأين: نواة صلبة جرى التعرف إليها سابقاً من خلال طرق مختلفة، ومعطف أجعد مكون من عناصر متحركة لم يكن معروفاً من قبل. نشاهد في الصورة أدناه الشكل الترسيمي الذي قدمه الباحثون في دراستهم، حيث يظهر بأن البروتين يتكون من شفعين من الضفائر المنحنية بشكل حرف C.
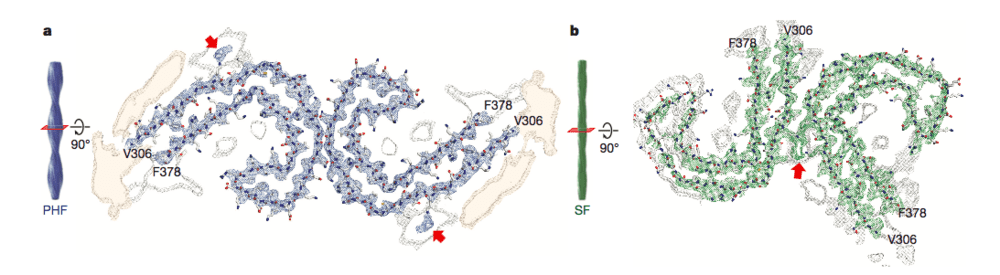
مصدر الصورة: مختبر مجلس الأبحاث الطبية للبيولوجيا الجزيئية
وحتى الآن، لم تنظر الأبحاث الرامية إلى فهم آلية تكدس بروتينات تاو (وهي عملية رئيسية في ظهور الأعراض المرضية) إلا في بنية النواة الصلبة للبروتين. وبما أن الدراسة الحديثة قد تمكنت من رسم الجزيء البروتيني بشكل كامل، فمن المتوقع أن يساعد ذلك على فهم أفضل لكيفية عمل هذا الجزيء. يقول سورز شيرز، اختصاصي البنى البيولوجية، وأحد مُعدي الدراسة الذين ينتمون إلى جامعة كامبريدج: "إن المساهمة الرئيسية التي قدمناها تكمن في الفهم الرئيسي لبنية وشكل هذه الخيوط على المستوى الجزيئي".
تُعد هذه النتائج ثمرة أكثر من 34 سنة من البحث في مجال داء ألزهايمر. فعلى الرغم من إدراك العلماء بأن بروتينات تاو هي عناصر رئيسية في نهج الإصابة بداء ألزهايمر منذ ثمانينيات القرن الماضي، إلا أن العلماء لم يتمكنوا من رسم كامل بنية البروتين بسبب عدم توفر التقنيات الموجودة حالياً. وإن التقنية الأساسية التي ساعدت علماء جامعة كامبريدج على النجاح تُدعى الفحص المجهري الإلكتروني cryo-EM، والتي مكنتهم من الحصول على صور للبروتين على المستوى الذري.
وفي معرض التعليق على نتائج الدراسة، يقول كلاودي ويشك، الباحث في مجال داء ألزهايمر في جامعة آبردين: "لقد حاولت طويلاً حل لغز هذا البروتين دون أن أتمكن من ذلك، وإنني متفاجئ حقاً بجمال بنيته والنتائج التي خلصت إليها الدراسة".
من المثير للاهتمام، بأن شكل البروتين (الذي يأخذ شكل حرف C) كان مشابهاً جداً للخمائر التي تُدعى بودسبورا أنسيرنا والتي يمكن أن تشكل بريونات فطرية (بروتينات منحنية يمكنها تحفيز البروتينات السليمة التي تواجهها على محاكاة التواءاتها والتفافاتها). يعني ذلك بأن بنية البروتين تحمل في ذاتها سر قدرته على نقل العدوى البروتينية وتحفيز بروتينات سليمة أخرى على التحول الشكلي، لتأخذ الشكل الشاذ الملتوي المترافق مع المرض التنكسي العصبي.
يقول ويشك: "من شأن فهمنا لبنية هذا البروتين أن يساعدنا على تطوير أدوية فعالة لداء ألزهايمر قادرة على تفكيك البروتين المعيب والتخلص منه".
وكان باحثون من كلية الطب بجامعة واشنطن الأميركية قد نشروا مؤخراً دراسةً حول اضطراب النوم المترافق مع داء ألزهايمر. وتعد تلك الدراسة مثالاً هاماً على ضرورة فهم بنية وشكل بروتين تاو لتحديد سبب المرض: فقد قام الباحثون بقياس مستويات بروتين تاو في الدماغ في حالتي النوم الاعتيادي والنوم المتقطع، وذلك بهدف تحري قدرة الدماغ على التخلص من تلك الجزيئات الشاذة في أثناء النوم ليلاً. وقد وجد الباحثون بأن النوم العميق يُعد مفتاحاً رئيسياً للتخلص من بروتينات تاو المعيبة. وإن معاينة بنية بروتين تاو بشكل دقيق ستساعد على فهم الآلية الجزيئية التي تقف وراء عملية التخلص من البروتين في أثناء النوم العميق.
قد يكون من المبكر الآن الحديث عن دواء فعال لداء ألزهايمر ومتاح في متناول جميع المرضى. ولكن، نظراً إلى تطور تقنيات التصوير المجهري الإلكتروني وجهود العلماء في مجال البيولوجيا الجزيئية، فلا بد أن نتمكن من فهم الآلية التي يؤثر بها داء ألزهايمر على الدماغ، وبالتالي علاجها.