تمكن العلماء في الولايات المتحدة من استخدام تقنية التعديل الجيني لعلاج حالات السرطان المتقدم لدى ثلاثة مرضى، وقد كانت النتائج الأولية واعدة في المرحلة الأولى من التجارب السريرية. يبدو العلاج آمناً حتى الآن، ومن المتوقع ظهور المزيد من النتائج قريباً.
ومن أجل تطوير نسخة من العلاج المناعي الأكثر أماناً وفعالية لمرضى السرطان؛ اشترك مجموعة من العلماء من جامعة بنسلفانيا ومعهد باركر للعلاج المناعي للسرطان في سان فرانسيسكو، وشركة «تِمنيتي ثيربتكس» المتخصصة في التكنولوجيا الحيوية في فيلاديلفيا؛ في العمل على ذلك. يقوم هذا العلاج على استخراج الخلايا المناعية من جسم المريض، ثم تدريبها على التعرّف على خلايا سرطانية محددة، ثم يُعاد حقنها مرة أخرى في جسم المريض، حيث تتكاثر وتهاجم الخلايا السرطانية وتقضي عليها.
وعلى النقيض من العلاج الكيميائي أو الإشعاعي الذي يقتل الخلايا السرطانية بشكلٍ مباشر؛ يعمل العلاج المناعي على تحفيز نظام المناعة في الجسم للقيام بهذا العمل بنفسه. استخدم الفريق تقنية «كريسبر» لتعديل الخلايا المناعية وتحويلها إلى جنود مدرّبة، حيث تقوم بتحديد أماكن الخلايا السرطانية والقضاء عليها. يأمل الفريق من خلال استخدام هذه التقنية، بتطوير شكلٍ أكثر فعالية من العلاج المناعي مع حدٍ أدنى من الآثار الجانبية.
لقد تدرّبتُ كصيدلاني وخبير في الهندسة الجزيئية الحيوية، وكنت مهتماً بشكل خاص بالاطلاع أكثر على حيثيات هذه التقنية الجديدة، لأن مختبري يُركّز جهوده على تقنية تعديل مُحرّرات الجينات. وبشكلٍ أكثر تحديداً، أحاول تطوير محررات جينية بالاعتماد أفضل بالاعتماد على تقنية كريسبر من أجل عملية تشخيص ومعالجة السرطان، وغيره من الأمراض. نحن نجمع عملياً بين التقنيات الكيميائية والحيوية وتكنولوجيا النانو لتصميم أدوات تحرير الجينات والتحكّم بها، وجعلها تعمل بكفاءة ودقة أكثر.
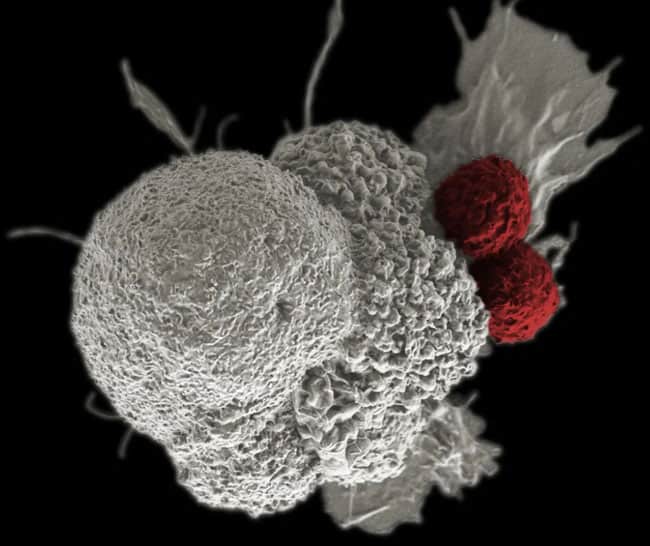
تدريب الخلايا المناعية على العثور على الخلايا السرطانية والقضاء عليها
تتمثل الخطوة الأولى في صنع هذه الخلايا القاتلة للأورام والمستخدمة في التجارب الأولية في عزل الخلايا التائية من دم مريض السرطان. الخلايا التائية هي نوع من خلايا الدم البيضاء تحارب العوامل الممرضة، والخلايا السرطانية. اشترك في الدراسة اثنان من المصابين بالسرطان النخاعي المتعدد (المايلوما المتعددة)، ومصاب واحد بالساركومة الشحمية (سرطان ينشأ من الخلايا الدهنية الموجودة في الأنسجة الرخوة العميقة).
قام العلماء بتدريب الخلايا التائية وتعزيز مهاراتها في مكافحة الخلايا الورمية، دون إلحاق الأذى بالخلايا الطبيعية من خلال تعديلها جينياً -تعطيل 3 جينات فيها، وإضافة جين واحد- قبل إعادتها إلى جسم المريض.
في الحالة العادية، يقوم أول جينين من الجينات المحذوفة بتشفير مستقبلات الخلايا التائية، وهي بروتينات موجودة على سطح الخلايا التائية يمكنها التعرّف على جزيئات محددة في الخلايا السرطانية -تُعرف بالمستضدات- والارتباط بها. عندما ترتبط الخلايا التائية المعدلة بهذه المستضدات، يسمح لها ذلك مهاجمة الخلايا السرطانية وقتلها مباشرة. لكّن المشكلة تمكن في أن الخلية التائية يمكن أن تتعرّف على مستضداتٍ مختلفة في الجسم، مما يجعلها أقل تركيزاً في العثور على الخلايا السرطانية. من خلال حذف هذين الجينين في الخلية التائية، تصبح أكثر مهارة في العثور على الخلايا السرطانية، ويقل احتمال مهاجمتها للخلايا الخطأ، وهي ظاهرة تُعرف باسم «المناعة الذاتية».
بالإضافة إلى ذلك، تم تعطيل جينٍ ثالث يسمى «بروتين موت الخلية المُبرمج 1» ويُشار إليه بالرمز «PD-1»، حيث يبطئ الاستجابة المناعية. بالتالي فإن تعطيل هذا الجين يرفع كفاءة الخلايا التائية.
بينما تمثلّت الخطوة الأخيرة في تدريب هذه الخلايا التائية من خلال إضافة جين ينتج مستقبلاتٍ جديدة يسمح لها بالتعرّف على مستضدّات معينة على الخلايا السرطانية تسمى «NY-ESO-1» والارتباط بها. والآن، بعد حذف 3 جينات وإضافة جين آخر، تصبح الخلايا التائية جاهزة لإعادتها من جديد إلى الجسم لمحاربة الخلايا السرطانية.
دور تقنية كريسبر في التجارب السريرية
إذاً، كيف قام الفريق بالضبط بتعديل الخلايا التائية؟ الإجابة هي استخدام تقنية تحرير الجينات المُسماة «كريسبر/كاس9»، والمكونة من عنصرين: دليل كريسبر الجزيئي الذي يعثر ويرتبط بالجين المُستهدف؛ والمقصّ الجزيئي «كاس9» الذي يقوم بقصّ سلسلة الحمض النووي المستهدفة. في نهاية المطاف يتم تعطيل الجين المُستهدف باستخدام هذه التقنية.
واستخدم الفريق تقنية «التثقيب الكهربائي» لخلق ثقوب مؤقتة في أغشية الخلايا التائية للسماح لبروتين «كاس9»، ودليل كريسبر بالنفاذ من خلالها لاستهداف الجينات الثلاثة في الخلايا التائية وتعطيلها.
بعد تعطيل الجينات الثلاث باستخدام تقنية كريسبر، استخدم الفريق فيروساً آمناً أُفقدت فعاليته لنقل الجين المراد إضافته إلى الخلايا التائية، والذي سيمكّنها من التعرّف على العلامة الخاصّة، المستضد NY-ESO-1، بالخلية السرطانية. إزالة الجينات الثلاثة من الخلايا التائية، ثم السماح لها بالتكاثر بشكلٍ يصل إلى المليارات منها في أطباق بتري؛ هي عملية تستغرق من عدّة أيام إلى أسابيع.
قبل أربعة أيام من حقن الخلايا التائية المُعدلة بتقنية كريسبر، أعطى الفريق لكل مريض من المرضى الثلاث جرعات متعددة من العلاج الكيميائي لخفض عدد خلايا الدم البيضاء الموجودة في أجسامهم.
أخيراُ، تم حقن ما يقرب من 100 مليون خلية من الخلايا التائية المُعدلة لكل كيلو جرام من وزن المريض في جرعةٍ واحدة.

مستقبل واعد لتقنية كريسبر
راقب الفريق المرضى لمدة 28 يوماً بعد حقن الخلايا التائية المُعدلة. ثم تمت متابعتهم كل شهر خلال الأشهر الستة التالية، ثم مرة كل ثلاثة أشهر لمراقبة أية استجابةٍ سلبية للجسم مثل ردّ فعل الجهاز المناعي. في الواقع، تنجم تأثيرات جانبية عن العلاج بالخلايا التائية مثل الحمّى وآلام العضلات، الصداع، اضطراب الرؤية وانخفاض ضغط الدم، والاضطرابات النزفية، اختلال وظائف أعضاء الجسم المتعددة، لكن الفريق لم يلاحظ أي علامات سمّية أو مرضية على المرضى. وهذا أمر مثير حقاً.
في حالة المريض الأول، أحد المصابين بالسرطان النخاعي المتعدد (المايلوما المتعددة)، استمر نمو الورم بعد 60 يوماً من حقن الخلايا التائية، حيث بدا أن العلاج لم ينجح في إيقاف السرطان بالنسبة للمريض الأول، لكّن المرحلة الأولى من التجارب السريرية كانت مصممة في الأساس لاختبار سلامة وأمان العلاج، حيث لم يلاحظ الفريق سمّية أو آثار جانبية على أيّ مريض.
وتمت مراقبة المريض الثاني المصاب بالساركومة الشحمية المتقدمة باستخدام الأشعة المقطعية المتسلسلة، وبدت حالته مستقرة بعد 90 يوماً. أما بالنسبة المريض الثالث، المصاب الآخر بالمايلوما المتعددة، فقد بدأ العلاج التجريبي مؤخراً ومن المبكّر الخروج بأي نتائج بالنسبة لحالته بعد.
إن حقيقة عدم وجود أي مشاكل جدية تتعلّق بتطبيق العلاج الجديد على مرضى السرطان، والذي ينطوي على استخدام تقنية تعديل الجينات اعتماداً على تقنية كريسبر؛ هو خطوة أولى رائعة نحو التوّسع في استخدامها في المجال الطبي.

