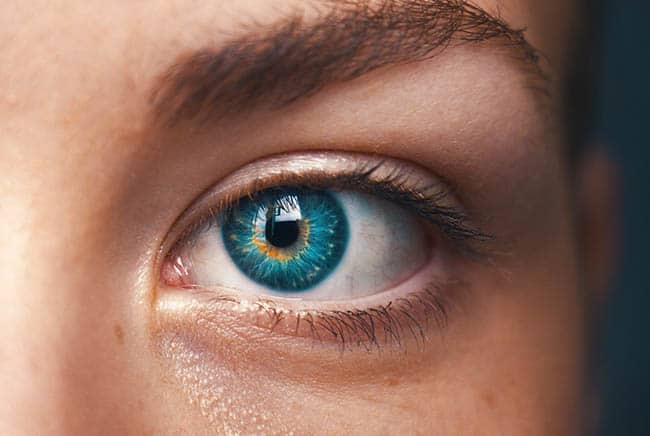
تلعب الجينات مجموعة متنوعة من الأدوار في تطوير وظيفة شبكية العين؛ مثل الجينات المرتبطة بخلايا المستقبلات الضوئية، أو الجينات المشتركة في النقل الضوئي، وهي العملية التي يتم من خلالها تحويل الضوء الذي يدخل العين إلى إشارات كهربائية تنتقل إلى الدماغ، وهناك جينات أخرى تلعب دوراً في وظيفة الأهداب، وهي ضرورية لتصور عدة أنواع من المدخلات الحسية، بما في ذلك الرؤية.
فقد البصر الوراثي
يحدث فقد البصر الوراثي (LCA) -وهو اضطراب وراثي نادر الحدوث- في نحو 14 جيناً ضرورياً للرؤية. يؤدي هذا الاضطراب إلى ضعف البصر الشديد، ويظهر في الولادة أو بعد أشهر قليلة منها. يصاب به 2 إلى 3 أطفال من بين 100 ألف طفل حديث الولادة، حيث يعد هذا المرض واحداً من أهم أسباب العمى لدى الأطفال. مؤخراً بدأ العلماء في استخدام تقنية «كريسبر» لعلاج فقد البصر الوراثي.
يرتبط مرض فقد البصر الوراثي بمشاكل الرؤية الأخرى، مثل حساسية الضوء، وقصر النظر الشديد، ولا يتفاعل الأطفال المصابون بمرض فقد البصر الوراثي بشكلٍ طبيعي مع الضوء، حيث يكون لدى الأطفال المصابون بالمرض؛ ضعف بصري شديد يبدأ في مرحلة الطفولة، وعلى الرغم من أن ضعف البصر يميل إلى الاستقرار إلا أنه قد يزداد سوءاً مع مرور الوقت.
ما هو كريسبر؟
كريسبر أو «التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد» (CRISPR) هو نوع من تسلسلات الحمض النووي الموجودة في خلايا بدائيات النوى، مثل البكتيريا والبكتيريا القديمة، ويوجد فيها فواصل مقتطعة من بقايا الحمض النووي للفيروسات التي سبق أن هاجمت الكائن بدائي النواة. يحتفظ الكائن بدائي النواة بهذه البقايا في حمضه النووي كفواصل يستخدمها لاحقاً؛ في الكشف عن الحمض النووي الخاص بتلك الفيروسات في هجماتها اللاحقة، ومن ثم تدميره بمساعدة بروتين «Cas9».
يطلق على عملية تحرير الجينوم اسم «تحرير الجينات»؛ وهي مجموعة من التقنيات التي تمنح العلماء القدرة على تغيير الحمض النووي للكائن الحي، سواء بالإزالة أو التغيير. وعبر هذه العملية؛ تمكن العلماء من استخدم نظام المناعة البدائي للبكتيريا، وتغيير الجينوم الخاص به، وخلق تقنية كريسبر الهائلة التي يمكن أن تعدل أي جين في أي نبات أو حيوان بسرعة وبكفاءة، وأيضاً تستخدم في مكافحة الفيروسات والأمراض.
استخدمت تقنية كريسبر (CRISPR /Cas9) لأول مرة في عامي 2012 و 2013، وسرعان ما بدأت معامل العلوم في جميع أنحاء العالم في استخدامها لتغيير الجينوم الخاص بالكائن الحي، حيث تمكن الباحثون من استخدمها بالفعل في إصلاح الأمراض الوراثية في الحيوانات، ومكافحة الفيروسات وتعقيم البعوض. كما كان تأثير كريسبر أكبر في مختبرات البيولوجيا الأساسية؛ نظراً لانخفاض التكاليف، ودقته، وسهولة التعامل معه.
هل يصلح كريسبر ما أفسدته الجينات الوراثية؟
وجد العلماء أن الطفرات الأكثر شيوعاً في مرض فقد البصر الوراثي تصيب الجين CEP29، وذلك عبر اختلال البروتين الذي يساعد في بناء خلايا مستقبلات الضوء الموجودة في الشبكية. هذا الجين هو ما جرى تعديله عبر استخدام تقنية كريسبر.
بدأت أولى التجارب على البشر على المستحضر الجديد وهو من إنتاج شركتيّ «Editas medicine» و«Allergan»، وسيخضع المرضى لإزالة جزء من الأنسجة الشبيهة بالهلام في أعينهم، ثم الحقن خلف الشبكية بالدواء الجديد، على أمل أن يتمكن الحمض النووي الخاص بالمريض باستعادة البروتين بشكل طبيعي، وبالتالي من الرؤية والإبصار.
رغم أن هذه ليست أول مرة يُستخدم فيها العلاج الجيني في علاج فقدان البصر الوراثي، فقد سبق وأن سمحت منظمة الغذاء والدواء الأميركية بتداول مستحضر (لوكستورنا) كعلاج جيني أواخر عام 2017 لعلاج أحد أنواع فقدان البصر الوراثي. يُعد هذا أول علاج جيني يستهدف الأمراض الوراثية يصرح به من منظمة الغذاء والدواء الأميركية، لكن الفرق بين لوكستورنا وبين العلاج الجديد هو أن الأول يستهدف نوع من فقدان البصر معروف بـ «LCA2»، وفيه يتم إدخال نسخة سليمة من الجين المضطرب إلى خلايا الشبكية مباشرةً، أما كريسبر فهو يحدد جزيء الحمض النووي في الجين المضطرب، ثم يقوم بقطعه ليعيد الجزيء إصلاح نفسه. ومن المنتظر إعلان نتائج تجربة كريسبر في عام 2020 بعد اختبارات الأمان والفعالية.
ختاماً، نجاح هذه التجربة يمثل تحدياً كبيراً أمام كريسبر، ويمثل أيضاً أملاً كبيراً لملايين البشر المصابين بفقدان البصر الوراثي.