الجدول الدوري هو جدول تنظم فيه جميع العناصر الكيميائية حسب الزيادة في العدد الذري، الذي هو العدد الإجمالي للبروتونات في نواة الذرة، ويكون لمجموعة العناصر في نفس العمود خصائص متشابهة. يساعد الدارسين والعلماء في فهم ودراسة الخصائص الفيزيائية والكيميائية للعناصر، وكيفية تفاعل عنصر مع آخر.
الجدول الدوري الأول
أوجد الجدول الدوري لأول مرة الروسي ديمتري آي مندلييف في عام 1869، كنتيجة للارتباط الواسع بين الخصائص والأوزان الذرية للعناصر، مع إيلاء اهتمام خاص للتكافؤ - أي عدد الروابط الفردية التي يمكن أن يشكلها العنصر- والذي بموجبه تظهر العناصر المرتبة وفقًا لحجم الأوزان الذرية تغيراً دورياً في الخصائص. وتوصل العالم الألماني يوليوس لوثر ماير بشكل مستقل إلى استنتاج مماثل، نُشر بعد ظهور ورقة مندلييف.
يتضمن الجدول الدوري الذي وضعه مندليف 17 عمود، مع صفين كاملين تقريبا من العناصر، من البوتاسيوم إلى البروم و من الروبيديوم إلى اليود، ويسبقه صفين من سبعة عناصر من الليثيوم الى الفلور و من الصوديوم إلى الكلور، وتليها ثلاث صفوف غير كاملة العناصر. و توقع مندليف وجود 17 عنصر غير مكتشف فترك لها مواقع فارغة في الجدول، وفعلا تم اكتشاف هذه العناصر لاحقا و وضعت في المواقع الفارغة التي تركها مندليف. ومع اكتشاف الغازات النبيلة في السنوات التالية، تمت إضافة مجموعة جديدة وضمهم في الجدول الدوري. وظل هذا الجدول مستخدماً بشكل عام حتى حوالي عام 1930.
قراءة الجدول
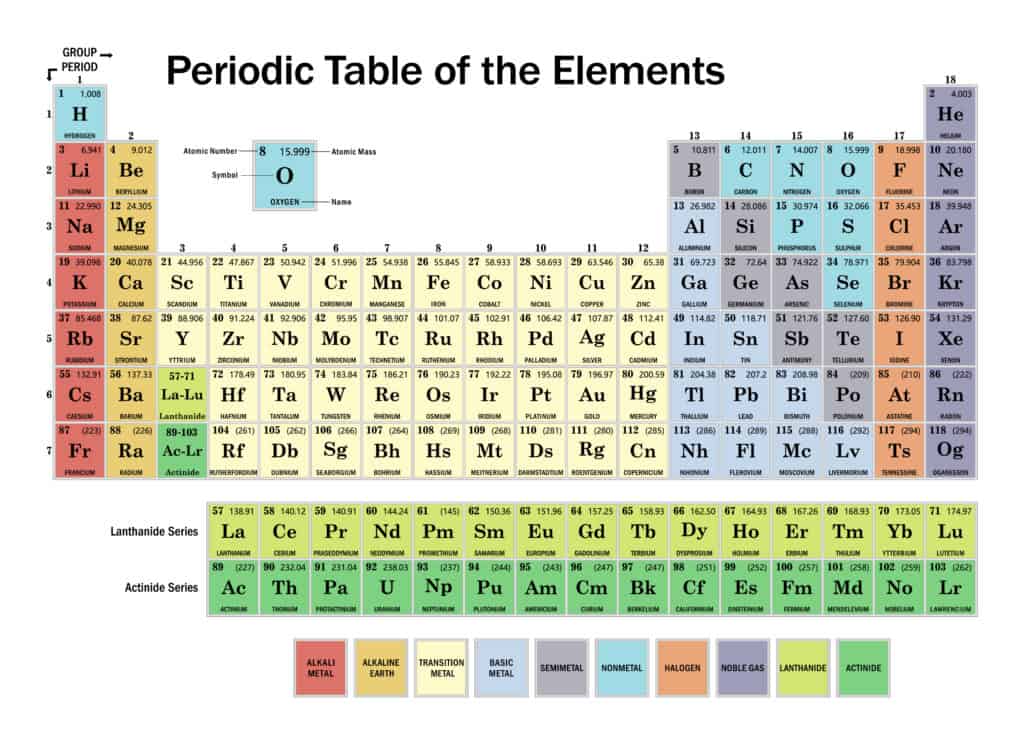
يتكون الجدول من مربعات، كل مربع يحتوي على اسم العنصر ورمزه وعدده الذري وكتلته الذرية وتوزعه الالكتروني. تُرتب هذه العناصر حسب تزايد العدد الذري في صفوف و أعمدة. وتقسم العناصر إلى 3 أقسام رئيسية هي، المعادن الواقعة على يسار ووسط الجدول الدوري تتشابه بخصائصها الفيزيائية و الكيميائية مثل اللمعان والبريق والناقلية الكهربائية وفقد الإلكترونات السطحية.
تقع اللامعادن تقع على يمين وأعلى الجدول الدوري، صفاتها عكس المعادن فهي رديئة النقل للحرارة والكهرباء، لا بريق لها وتميل إلى كسب الإلكترونات. أما أشباه المعادن تقع على جانبي الخط المتعرج في الجدول الدوري لها خصائص المعادن واللامعادن معاً.
تتم الإشارة إلى سلسلة أفقية من العناصر في الجدول على شكل صفوف باسم الأدوار والسلسلة الرأسية للعناصر كمجموعات تسمى فصائل، نوضحها بشيء من التفصيل:
الصفوف المعروفة باسم الأدوار
تم ترتيب العناصر حسب الزيادة في أعدادها الذرية، في 7 أدوار أفقية، يضاف لها اللانثانيدات من اللانثانوم 57، إلى اللوتيتيوم 71 والأكتينيدات من الأكتينيوم 89 إلى اللورنسيوم 103 المشار إليها بشكل منفصل أدنى الجدول. تتفاوت أطوال الأدوار، فيتكون الدور الأول من عنصري الهيدروجين 1والهيليوم 2. ثم الصفان الثاني والثالث الذي يتكون كل منهما من ثمانية عناصر، يبدأ الدور الثاني من الليثيوم 3 إلى النيون 10؛ والثالث من الصوديوم 11 حتى الأرجون 1.
يليهم دوران يتكون كل منهما من 18 عنصراً: الدور الرابع يبدأ من البوتاسيوم 19 إلى الكريبتون 36؛ والخامس من الروبيديوم 37 إلى الزينون 54. ثم لدينا دوران طويلان جدأ هما الدور السادس المكون من 32 عنصراً، من السيزيوم 55 حتى الرادون 86، تتكثف في 18 عموداً عن طريق حذف اللانثانيدات المشار إليها بشكل منفصل أدناه، مما يسمح بوضع العناصر الثمانية عشر المتبقية، والتي تتشابه إلى حد كبير في خصائصها مع العناصر المقابلة للدورين الطويلين الأول والثاني، أسفل هذه العناصر مباشرة. والدور السابع الطويل والأخير، من الفرانسيوم 87 إلى الأوغانيسون 118، يماثل الدور الذي قبله بوضعه في 18 عموداً بحذف الأكتينويدات.
المجموعات المعروفة باسم الفصائل
تمتلك كل مجموعة من العناصر الموجودة في عمود معين مجموعة من الخصائص المتشابهة، فالعناصر في كل مجموعة لها نفس عدد الإلكترونات في المدار الخارجي. تسمى هذه الإلكترونات الخارجية أيضاً بإلكترونات التكافؤ، بعض هذه المجموعات تسمى باسماء شائعة وبعضها الأخر يعرف برقم فقط. هذه المجموعات هي، المجموعة الأولى التي تقع في العمود الأول، تتضمن المعادن القلوية 1A، من الليثيوم والصوديوم، المعادن من البوتاسيوم أسفل الجدول إلى الفرانسيوم، تتميز عناصرها بتحرير إلكترونها السطحي بسهولة وأغلبها له بريق أبيض معدني وجيدة النقل للحرارة. أما المجموعة الثانية التي تقع في العمود الثاني، هي المعادن القلوية الترابية 2A، وتشمل البريليوم والمغنيسيوم والكالسيوم والسترونتيوم والباريوم والراديوم، تمتاز ببريق أبيض فضي وهي أكثر قساوة من المعادن القلوية، كما أنها جيدة النقل للحرارة والكهرباء.
على الرغم من إدراج الهيدروجين في المجموعة الأولى، إلا أنه لا يشبه إلى حد كبير المعادن القلوية في خواصها الكيميائية. في الواقع، يعتبر الهيدروجين أكثر العناصر فردية وهو العنصر الوحيد الذي لا يمكن اعتباره عضواً في مجموعة.
مجموعة الهالوجينات 7A تتضمن الفلور والكلور والبروم واليود والأستاتين والتنسين. عند درجة الحرارة العادية يكون كلاً من الكلور والفلور بالشكل الغازي، والبروم سائل واليود صلب. ويضم العمود الثامن عشر مجموعة الغازات النبيلة الستة، الهيليوم والنيون والأرجون والكريبتون والزينون والرادون، تجدها في نهايات الصفوف الست المكتملة، وتتميز بعدم تكوينها لروابط مع عناصر أخرى.
المجموعات الأربع الأخرى التي تُعرف برقم هي كما يلي: مجموعة البورون وتشمل مجموعة العناصر في العمود 13،وتتكون من البورون والألمنيوم والغاليوم والإنديوم والتاليوم. و مجموعة الكربون 14، وتتكون من الكربون والسيليكون والجرمانيوم والقصدير والرصاص والفلروفيوم؛ ومجموعة النيتروجين 15، تشمل النيتروجين والفوسفور والزرنيخ والأنتيمون والبزموت والمسكوفيوم. وأخيراً المجموعة 16، تشمل الأكسجين والكبريت والسيلينيوم والتيلوريوم والبولونيوم وليفرموريوم.
ويطلق على عدد من عناصر كل صف طويل اسم المعادن الانتقالية، عادة ما تؤخذ على أنها سكانديوم 21 إلى زنك 30 وتسمى معادن انتقالية لمجموعة الحديد؛ أما الإيتريوم 39 إلى الكادميوم 48 تُعرف بالمعادن الانتقالية لمجموعة البلاديوم؛ و الهافنيوم 72 إلى الزئبق 80 هي معادن مجموعة البلاتين الانتقالية. وفي النهاية تسمى اللانثانيات والأكتينيدات بالأتربة النادرة.

