واجه علماء البيولوجيا الدقيقة في شركة دانيسكو يو إس أيه (Danisco USA) المحدودة المسؤولية مشكلة في نهاية القرن العشرين، وهي أن البكتيريا التي استخدموها لتحضير اللبن والجبنة تصيبها الفيروسات. بعد دراسة المسألة أكثر، اكتشف العلماء أن بعض أنواع البكتيريا يتمتّع بنظام دفاعي يساعدها على مقاومة هذه الفيروسات الغازية.
احتوت هذه الأنواع من البكتيريا المقاومة للفيروسات على مجموعات غريبة ومكررة من أحرف الحمض النووي في كروموسوماتها، وهي قطع من الحمض النووي اكتسبتها بعد التعرّض للفيروسات و"حفظتها" في جينوماتها. قدرة هذه البكتيريا على الاحتفاظ بالحمض النووي هي خاصية ذاكرة جزيئية تشبه الطريقة التي يتذكّر الجهاز المناعي البشري وفقها الأجسام الغازية لتركيب الأجسام المضادة بهدف مقاومة حالات العدوى المتكررة.
في هذه الحالة، يمزّق هذا الجهاز المناعي الميكروبي، الذي يحمل اسم نظام كريسبر-كاس (CRISPR-Cas، أو كريسبر اختصاراً)، الجينومات الفيروسية التي تطابق السلاسل الموجودة في مخزون الذاكرة الجزيئية للبكتيريا.
لم يكن هؤلاء العلماء يبحثون عن الأداة الثورية الجديدة في مجال التكنولوجيا الحيوية، وكان هدفهم يتمثل في حفظ المنتجات المخزنة في الأحواض المستخدمة. لكن أدرك علماء آخرون بعد ذلك بوقت قصير الإمكانات المحتملة لاستخدام نظام كريسبر لتحقيق أهدافهم الخاصة؛ إذ أتاح لهم هذا النظام بعد إجراء تعديلات طفيفة عليه قطع أي سلسلة جينية حسب حاجتهم، ما سهّل عملية الهندسة الوراثية للغاية.
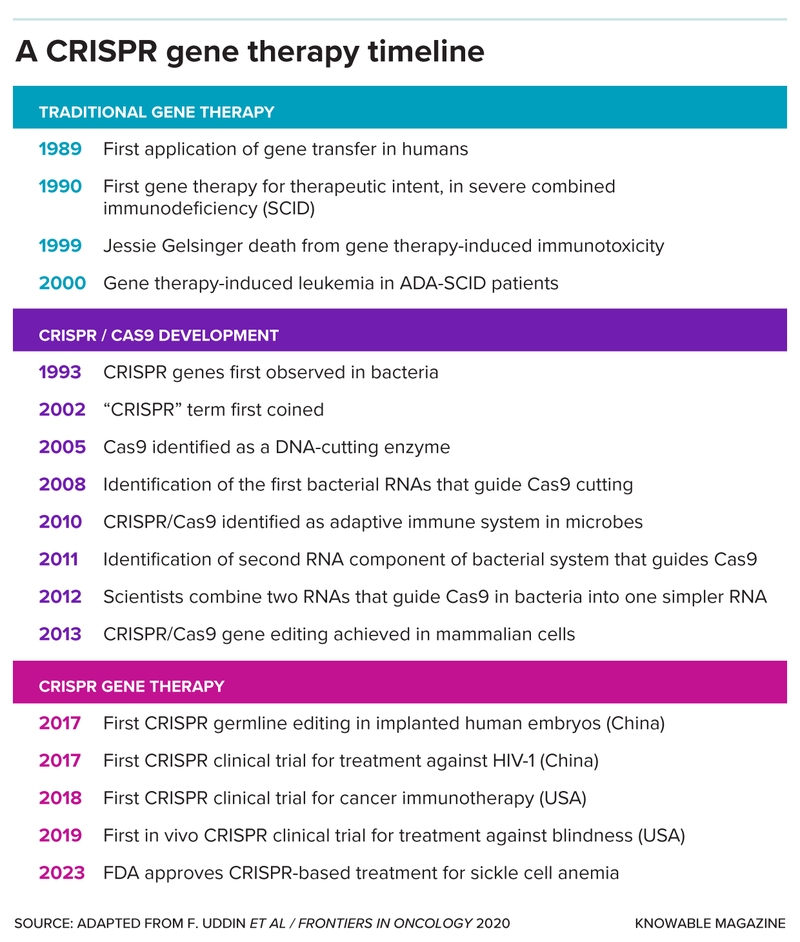
أحدثت أنظمة كريسبر ثورة حقيقية في مجال التكنولوجيا الحيوية؛ إذ حصل مستخدموها على جائزة نوبل وتسببت ببدء حقبة جديدة في مجال العلاجات الجينية. منحت إدارة الغذاء والدواء الأميركية الموافقة لأول علاج لتغيير الجينات معتمد على تكنولوجيا كريسبر في ديسمبر/كانون الأول 2023، وهو علاج جيني جديد لاضطراب فقر الدم المنجلي الذي يتسبب بآلام شديدة.
يقول خبير الهندسة التطورية في إم آي تي ميديا لاب في مدينة كامبريدج في ولاية ماساتشوستس الأميركية، كيفن إسفيلت: "أحدثت هذه التكنولوجيا ثورة في مجال الأبحاث؛ إذ إنها سرّعت التقدم في مجال التكنولوجيا الحيوية برمته".
واجه العلماء سؤالاً مقلقاً منذ أن اكتشفوا أنظمة كريسبر. هل توجد أنظمة مشابهة معدِّلة للجينات لدى الحيوانات والنباتات والفطريات أيضاً؟ (وهي أشكال الحياة المعروفة باسم حقيقيّات النوى، التي يميّزها احتواؤها على النوى التي تحتوي بدورها على المواد الجينية).
اقرأ أيضاً: تقنية كريسبر للتعديل الجيني تنجح في تخفيض مستويات بروتينات شاذة مسببة للأمراض في الدم
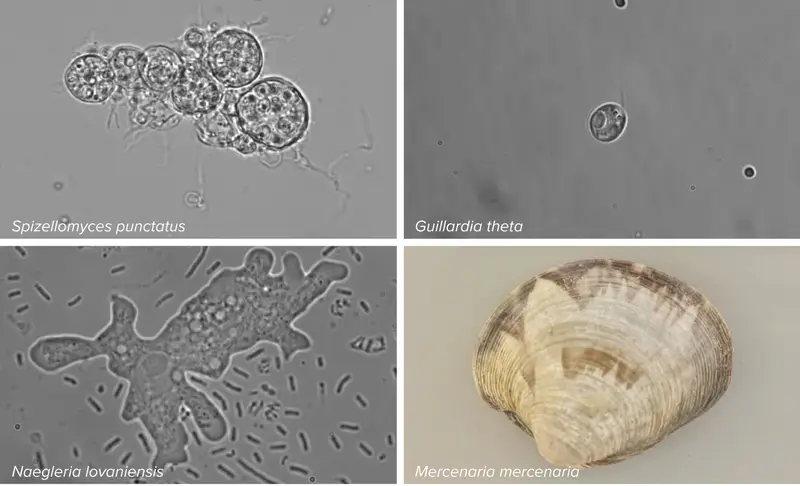
يعلم العلماء الآن أن جواب هذا السؤال هو نعم، وذلك وفقاً لورقة بحثية نُشرت في يونيو/حزيران 2023 في مجلة نيتشر (Nature) ألّفها عالم البيولوجيا الجزيئية، فينغ تشانغ، وزملاؤه من معهد برود التابع لمعهد ماساتشوستس للتكنولوجيا وجامعة هارفارد في مدينة كامبريدج في ولاية ماساتشوستس. اكتشف الفريق وجود أنظمة شبيهة بنظام كريسبر تقطع الحمض النووي وتحمل اسم الفانزورات (Fanzors) في مجموعة غريبة من الأحياء الحقيقية النوى الأسيرة، التي تضم الفطريات والطحالب والأميبات ونوعاً من المحار يحمل اسم المحار الصلب الشمالي.
أشاد الباحثون بالنتائج الجديدة باعتبارها إضافة مدهشة لشجرة عائلة أنظمة كريسبر، لكن الاكتشاف الجديد يُثير المزيد من الأسئلة. ما وظيفة الفانزورات؟ وهل هي قادرة أيضاً على إحداث ثورة في التكنولوجيا الحيوية؟ وأيضاً، هل من المحتمل أن تكون أنظمة كريسبر وفانزور واحدة من عدد هائل من أنظمة قطع الحمض النووي التي يمكن أن نكتشفها؟
سنستعرض في هذا المقال بعضاً مما يعرفه العلماء عن أنظمة كريسبر الميكروبية وأنظمة فانزور المكتشفة حديثاً.
ما أنظمة كريسبر؟
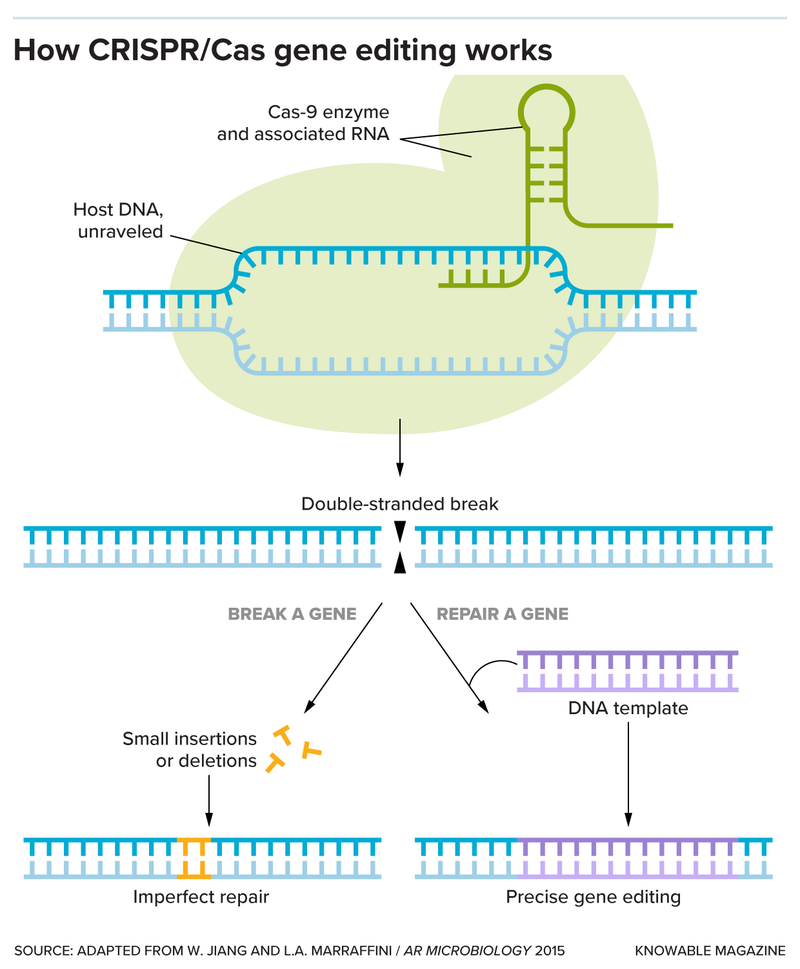
قطع سلاسل الحمض النووي إلى أجزاء ليس ظاهرة عظيمة بحد ذاته، والحيلة المميزة التي تطبّقها أنظمة كريسبر هي أنها تقطع هذه السلاسل في نقاط محددة ومستهدفة فقط. يتطلب ذلك عاملين؛ الأول هو دليل يرشد إلى موقع القطع، وهو قطعة صغيرة من الحمض النووي الريبوزي (الرنا) تطابق سلسلة الحمض النووي المستهدفة. بينما الثاني هو بروتين، إنزيم يؤدي دور المقص. اكتسبت الميكروبات عدداً من الإنزيمات القاطعة التي تقص الحمض النووي، ومنها كاس 9 وكاس 12.
عندما تُصاب الميكروبات بالفيروسات، تجمع الميكروبات قطعاً صغيرة من السلاسل الجينية الفيروسية وتخزّنها في جزء من جينومها يحمل اسم تكرارات كريسبر. ستتمكن الميكروبات من استخدام هذه السلاسل لتركيب الرنا الدليل عندما تُصاب بالفيروسات نفسها مجدداً. تستخدم عندها هذه الميكروبات المقصّات الإنزيمية لقطع المواد الجينية الفيروسية والدفاع عن نفسها.
يتمتّع نحو نصف أنواع البكتيريا المعروفة ومعظم أنواع الميكروبات الأخرى التي تحمل اسم العتائق بأنظمة كريسبر-كاس. والمثير للدهشة أن هناك فيروسات تطبّق آلية كريسبر-كاس لمقاومة الميكروبات بدورها. حتى وقت إجراء الدراسة الجديدة السابقة الذكر، كانت حقيقيّات النوى هي الأحياء الوحيدة التي لم يتحقق الباحثون إن كانت تتمتع بأنظمة كريسبر.
ما إسهامات تكنولوجيا كريسبر في مجال التكنولوجيا الحيوية؟
تستخدم الكائنات الحية جميعها رمز الحمض النووي الأساسي نفسه والبروتينات الأساسية نفسها، ما يعني أنه يمكن استخدام نظام كريسبر-كاس نظرياً في أي كائن حي. مع ذلك، يجب إجراء بعض التعديلات عموماً.
التطبيق الأبسط لهذا النظام هو قطع أجزاء الحمض النووي غير المرغوب فيها. عندما يقطع إنزيم كاس أحد الجينات المستهدفة، تحاول الخلية ترميم الحمض النووي، ولكنها قد تتسبب بتشكّل جين تالف لأن هذه العملية ليست خالية من الأخطاء. قد يكون إتلاف الجينات هو المطلوب في بعض التطبيقات، ويعتمد أحد علاجات فقر الدم المنجلي المحتملة على هذه الطريقة.
اقرأ أيضاً: علماء أحياء ينجحون في تفقيس بيوض قراد معدلة جينياً بتقنية كريسبر
يصاب الجسم بهذا الاضطراب عندما تكون الجينات التي ترمّز بروتين الهيموغلوبين الدموي معتلّة. لكن الجسم يحتوي أيضاً على جين آخر لتركيب الهيموغلوبين تستخدمه الأجنة فقط. ويسعى العلماء إلى إعادة تفعيل الهيموغلوبين الجنيني الفعال في خلايا دم البالغين. هناك جين آخر أيضاً يحمل اسم بي سي إل 11 أيه (BCL11A) يلغي تفعيل الجين الذي يرمّز الهيموغلوبين الجنيني.
يعتمد العلاج الجديد الذي منحته إدارة الغذاء والدواء الموافقة على تكنولوجيا كريسبر لإتلاف هذا الجين، ما يتيح للجين الذي يرمز الهيموغلوبين الجنيني أداء وظائفه في خلايا البالغين. وافقت إدارة الغذاء والدواء أيضاً على استخدام هذا العلاج لدى المصابين باضطراب ثلاسيميا بيتا في يناير/كانون الثاني 2024.
يستطيع الباحثون أيضاً بتطبيق بعض الحيل الجزيئية الإضافية استخدام تكنولوجيا كريسبر لإضافة سلاسل جينية جديدة أو إصلاح الجنيات التالفة.
يختبر العلماء أيضاً العلاجات المعتمدة على أنظمة كريسبر-كاس لعلاج السكري وأحد أنواع الداء النشواني وحالات العدوى المختلفة مثل الإيدز، بالإضافة إلى عدة أنواع من السرطان. هذا ليس كل شيء؛ إذ يطبّق الباحثون تكنولوجيا كريسبر لتحويل الخنازير إلى متبرعين محتملين بالأعضاء للبشر وإنتاج الفواكه ذات الجودة الأعلى التي تتمتع بمقاومة ضد الأمراض والقضاء على البعوض الذي ينقل الملاريا.
مع ذلك، هناك جوانب سلبية لهذه التكنولوجيا. قطع أشرطة الحمض النووي لدى البشر صعب؛ إذا قطع أحد إنزيمات كاس الحمض النووي في المكان الخطأ، أو إذا حدث خطأ ما في عملية الترميم، فقد يغيّر العلاج الجينوم بطريقة تحفّز تشكّل الخلايا السرطانية. بالتالي، يعتمد العديد من النُهج المعتمدة على أنظمة كريسبر على نسخ معدّلة من بروتين كاس لا تقطع الحمض النووي تماماً بل تعدّله بطرق أدق وأكثر أماناً.
كيف اكتُشِفت أنظمة فانزور؟
يقول عالم الوراثة في جامعة كاليفورنيا في مدينة ديفيس، ديفيد سيغل، الذي كتب عن العصر الجديد لهندسة الجينوم في مجلة المراجعة السنوية لعلم الجينوم وعلم الوراثة البشري (Annual Review of Genomics and Human Genetics) في عام 2013، إن أنظمة فانزور كانت "مختبئة على مرأى من الجميع". وُصفت جينات فانزور أول مرة في العام نفسه، لكن لم يعلم أحد أنها ترمّز إنزيماً يشبه إنزيم كاس.
شارك الباحث في معهد أبحاث المعلومات الوراثية في مدينة كوبرتينو في ولاية كاليفورنيا، ويدونغ باو، في تأليف أول دراسة عن أنظمة فانزور عام 2013. لم يكن باو وزميله يبحثان عن مقصّات الحمض النووي، بل كانا مهتمين بجينات تُسمَّى عادة "الجينات القافزة".
هذه الجينات هي سلاسل من الحمض النووي تستطيع القفز من نقطة في الجينوم وإعادة إدخال نفسها في نقطة أخرى. أشهر الأمثلة على هذه الجينات القافزة، التي يُطلق عليها أيضاً اسم الينقولات، هي تلك التي اكتشفت عالمة الوراثة، باربرا مكلينتوك، أنها تؤدي دوراً في التحكم في لون حبوب الذُّرة، وحصلت على جائزة نوبل لقاء هذا الاكتشاف. في الواقع، يتألف نحو نصف الجينوم البشري من الجينات القافزة، ولكن أغلبيتها لم تعد قافزة بعد الآن.
اقرأ أيضاً: لأول مرة استخدام كريسبر لتحرير الجينات في علاج مرضٍ وراثي
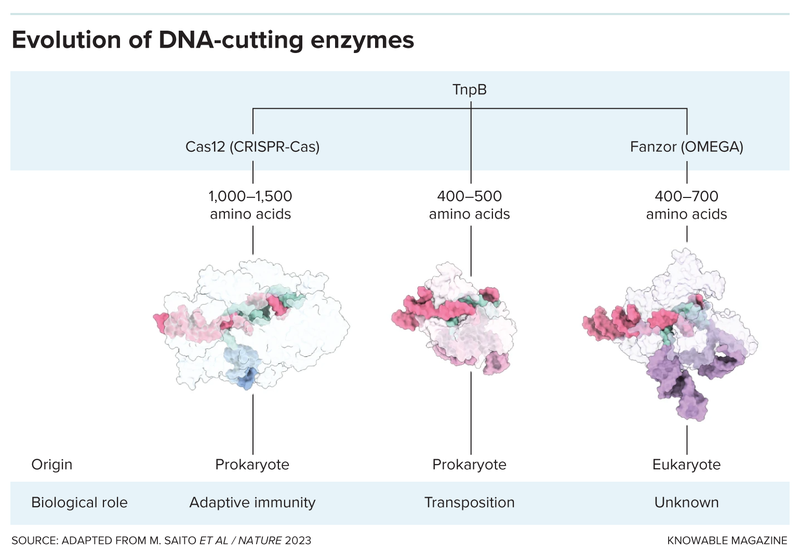
علم باو أن الجينات القافزة في البكتيريا تضم عادة جيناً بوظيفة غير معروفة يحمل اسم تي إن بي بي (TnpB). بدأ باو البحث عن جينات مشابهة واكتشفها في جينومات أكثر من 20 نوعاً من حقيقيّات النوى، منها نوع من الذباب والخمائر والعفن والأميبات والعديد من أنواع الطحالب. أطلق الباحثون على النسخة من هذا الجين الغامض الموجودة في حقيقيات النوى اسم جين فانزور بدلاً من تي إن بي بي.
اكتشف تشانغ وزملاؤه أيضاً جينات فانزور بالخطأ في دراسة نُشرت عام 2021. كان هؤلاء ينشئون شجرة عائلة لأنظمة كريسبر-كاس تبيّن كيف تطوّرت أنظمة قطع الحمض النووي الموجّهة بالرنا هذه، ما دفعهم إلى مسح الجينات والبروتينات في مجموعة متنوعة من الكائنات الحية بحثاً عن أنظمة مشابهة. اكتشف الباحثون أن جينات فانزور هي أبناء عمومة جينات كاس البكتيريّة، وأن العائلتان تنحدران من جين تي إن بي بي.
هل تقطع جينات فانزور الحمض النووي كما تفعل أنظمة كريسبر-كاس؟
جادل تشانغ وزملاؤه بأنه إذا كانت جينات فانزور وجينات كاس في أنظمة كريسبر هي أبناء عمومة انفصلوا منذ زمن بعيد، فقد تحمل جينات فانزور أيضاً تعليمات لترميز بروتين قادر على قطع الحمض النووي. يمكن أن نستنتج من هذه الفرضية أيضاً أن بروتين فانزور قد يستخدم سلاسل الرنا الدليل أيضاً للعثور على سلاسل الحمض النووي المحددة وقطعها.
دفع ذلك الباحثين إلى اختبار هذه الفرضية من خلال وضع جينات فانزور في أطباق تحتوي على خلايا الكلى البشرية. واكتشفوا أن هذه الجينات تُرجمت لتركيب بروتينات فانزور. بعد ذلك، أضاف العلماء سلاسل الرنا الدليل إلى بروتينات فانزور الناتجة وتركوها مدة 3 أيام. إذا كانت بروتينات فانزور هي إنزيمات تقطع الحمض النووي، سترمم الخلايا الحمض النووي المقطّع مجدداً لكن على نحو غير مثالي، ما يؤدي إلى حذف بعض الأجزاء أو إضافة أجزاء أخرى في المواقع المطابقة لسلاسل الرنا الدليل. وهذا ما لاحظه العلماء تماماً.
يعني ذلك أن الفانزورات هي إنزيمات قاطعة للحمض النووي وموجّهة بالرنا الدليل بالفعل.
هل ستؤدي الفانزورات دوراً تكميلياً لأنظمة كريسبر-كاس في مجال التكنولوجيا الحيوية أم ستستبدلها؟
لا تجعل القدرة على قطع بعض الجينات في الأطباق الفانزورات الأداة الثورية الجديدة في مجال التكنولوجيا الحيوية. أهم إنجاز تمكّن فريق تشانغ من تحقيقه حتى الآن هو قطع موقع الجين المستهدف في 18.4% من المرات، ولم يحاول العلماء حتى ترميم جين تالف باستخدام الفانزورات. لا تقترب هذه الفاعلية من فاعلية أنظمة كريسبر-كاس، التي تتمتّع بأفضلية تتمثّل في أن العلماء قضوا سنوات طويلة في تحسينها.
اقرأ أيضاً: إنجاز سعودي: باحثون من جامعة الملك عبدالله يبتكرون تقنية جديدة في التحرير الجيني
إحدى الأفضليات المحتملة التي تتمتع بها أنظمة فانزور على أنظمة كريسبر-كاس هي حجمها الصغير. يعد إدخال كل من إنزيم كاس والرنا الدليل، وربما بعض المكونات الضرورية الأخرى، إلى الخلايا المراد تعديلها صعباً بسبب أحجام هذه العناصر. يضع العلماء غالباً هذه المكونات في فيروس حميد لإدخالها إلى الخلايا، لكن الفيروسات المستخدمة عادة لا تتسع هذه المكونات جميعها. تتسع هذه الفيروسات إنزيم فانزور الأصغر حجماً على نحو أفضل. مع ذلك، صمم العلماء بالفعل نسخاً مصغّرة من إنزيمي كاس 12 وكاس 13 يمكن وضعها في الفيروسات الحميدة. لذلك، لا يعد صغر الحجم أفضلية حقيقية للفانزورات.
بالإضافة إلى ذلك، يقول إسفيلت إن الفانزورات تعاني عيباً محتملاً يتجلّى في تطبيقات الهندسة الوراثية. يتطلّب استخدام أنظمة كريسبر-كاس عادة تطابق الرنا الدليل مع سلاسل الحمض النووي التي يتراوح طول كل منها بين 18 و20 حرفاً جينياً، أو أساساً جينياً. يقدّر إسفيلت أنه من المرجح عدم وجود أكثر من سلسلة واحدة مثالية لكل جينوم. يعني ذلك أنه من غير المرجّح أن يقطع إنزيم كاس الجينوم في أي مكان باستثناء الموقع المستهدف، وهذا أمر جيد لضمان أمان العلاجات الجينية. من ناحية أخرى، يتطابق جين فانزور مع 15 أساساً جينياً في الحمض النووي فقط.
ويقول إسفيلت إن احتمال تكرار هذه السلسلة القصيرة في عدة مواقع من الجينوم أكبر بكثير. في هذه الحالة، سيقطع جين فانزور الموقع المستهدف والمواقع الأخرى المطابقة أيضاً، ما يُفشل العلاج الجيني تماماً. الأفضلية لأنظمة كريسبر-كاس
يقول المتخصص في أمراض النبات في مختبر سينزبيري في مدينة نورويتش في المملكة المتحدة، سوفين كامون، الذي راجع استخدام تكنولوجيا كريسبر في هندسة نباتات المحاصيل، إن الحقيقة هي أن تكنولوجيا كريسبر تعمل "بفاعلية في أغلبية الكائنات الحية". مع ذلك، يشير كامون إلى أن أنظمة فانزور قد تفيد العلماء الذين يدرسون بعض أنواع البكتيريا التي تعد إنزيمات كاس سامة بالنسبة لها.
لذلك عموماً، لا يوجد سبب يدفع أغلبية المختبرات إلى استبدال أنظمة كريسبر-كاس بأنظمة فانزور. يقول سيغل، الذي يعمل على تطوير العلاجات لاضطرابات النمو العصبي: "أُفضّل استخدام تكنولوجيا مألوفة بالنسبة لنا. هناك ما يكفي من التفاصيل التي نجهلها لدرجة أني لست مضطراً للقلق بشأن استخدام إنزيم جديد".
ما الوظيفة الطبيعية لأنظمة فانزور؟
على الرغم من كل ما سبق، تعد الفانزورات اكتشافاً بيولوجياً رائعاً. يقول إسفيلت: "وجود أنظمة شبيهة بأنظمة كريسبر في مختلف ممالك الحياة مذهل".
على الرغم من أن العلماء يعرفون الوظيفة التي تؤديها أنظمة كريسبر-كاس في الميكروبات، فإن وظيفة بروتينات فانزور في الطبيعة ليست واضحة تماماً بالنسبة لهم. يعتقد الباحثون أن هذه البروتينات تؤدي وظيفة مشتركة مع الجينات القافزة بطريقة أو بأخرى، ربما أنها تساعد هذه الجينات على أداء وظائفها أو تنتقل معها عندما تقفز.
اقرأ أيضاً: علاج جيني يُلغي الحاجة لنقل الدم المتكرر عند مرضى الثلاسيميا
أحد الاحتمالات التي أخذها فريق تشانغ في الاعتبار هو أن جينات فانزور تؤدي إلى إنشاء نظام دفاعي خاص بالجينات القافزة. ففي النهاية، قطع الحمض النووي القادرة على الدخول من الجينوم والخروج منه وتغيير الحمض النووي في هذه العملية ليست مفيدة للخلية عادة، ما يعني أنه من المحتمل أن الخلايا طوّرت آلية دفاعية ما.
قد تعمل هذه الآليات الدفاعية المفترضة المعتمدة على الفانزورات كما يلي: ينتقل أحد الجينات القافزة إلى مناطق في الجينوم تحتوي على السلسلة الجينية نفسها التي يقطعها الفانزور المرتبط بالجين القافز. ثم يدمّر الجين القافز الموقع الذي يستهدفه الفانزور بهذه العملية، ما يقي جينوم الخلايا من القطع.
ولكن إذا أزالت الخلية الجين القافز، فإنها سترمم الموقع الذي يستهدفه الفانزور، ما يجعل جينومها عرضة لعملية القطع التي يجريها الفانزور.
يتوقع تشانغ أن هذه الآلية تنطوي في جوهرها على أن الجين القافز يحفّز الخلية على عدم طرده من الموقع لأنه سيقفز عندها إلى موقع آخر وسيركّب إنزيم فانزور جديد ويعود ليقطع الموقع الذي طُرد منه. يبدو من الأسلم في هذه الحالة عدم طرد الجين القافز من الموقع.
مع ذلك، هذه مجرد احتمالية لا أكثر.
يقول تشانغ إن البشر من الكائنات الحية التي لا تحتوي على الفانزورات على نحو طبيعي. لكن من المحتمل أن البشر يمتلكون نظاماً شبيهاً آخر لقطع الحمض النووي ينتمي إلى عائلة جينات فانزور وكاس. يعمل فريق تشانغ حالياً على البحث عن هذه الأنظمة. يقول تشانغ: "نحاول اكتشاف أكبر عدد ممكن من هذه الأنظمة".

