مُنِحت جائزة نوبل في الطب لكاتالين كاريكو ودرو وايسمان، وهما اثنان من العلماء الذين ساعد عملهم على تمهيد الطريق أمام صناع لقاحات الحمض النووي الريبي المرسال المضاد لكوفيد-19. كاريكو مختصة بالكيمياء الحيوية من جامعة ساغان في هنغاريا، وأستاذة مساعدة في جامعة بنسلفانيا. شغلت كاريكو سابقاً أيضاً منصب نائبة الرئيس ورئيسة قسم استبدال البروتينات في الحمض النووي الريبي في شركة بيو إن تيك (BioNTech) حتى العام 2022، وكانت مستشارة للشركة. أما وايسمان فهو باحث مختص باللقاحات في كلية بيرلمان للطب بجامعة بنسلفانيا، ومدير معهد بنسلفانيا لابتكارات الحمض النووي الريبي.
تتولى جمعية نوبل في معهد كارولينسكا -الجامعة الطبية- في السويد مهمة منح الجائزة، وتُمنَح مع هذه الجائزة ميدالية ذهبية مميزة بشعارها الطبي، إضافة إلى مبلغ مليون دولار تقريباً (11 مليون كرونة سويدية).
وقد كتبت اللجنة في بيانها الصحفي: "توصل الفائزان إلى اكتشافات ثورية أحدثت تغييراً ثورياً في فهمنا لتفاعل الحمض النووي الريبي المرسال مع نظامنا المناعي، ما أسهم في رفع وتيرة تطوير اللقاحات إلى درجة غير مسبوقة في خضم أحد أسوأ التهديدات التي تعرضت لها صحة البشر في العصر الحديث".
مرحلة مفصلية في تطوير اللقاحات
سابقاً، كان استزراع الفيروسات، أو على الأقل بعض الأجزاء منها، ضرورياً لصنع اللقاح. وغالباً ما كانت الفيروسات تُستَزرَع في أوعية ضخمة من الخلايا، أو داخل بيض الدجاج، على غرار أغلبية لقاحات الأنفلونزا. بعد ذلك، كانت الفيروسات تخضع لعملية تنقية قبل تحويلها إلى لقاحات.
اقرأ أيضاً: كيف يمكن أن يؤدي تطوير لقاحات للتماسيح إلى حل مشكلات كبيرة في القطاع الطبي البشري والبيطري؟
أما استخدام الحمض النووي الريبي المرسال فهو مختلف تماماً. حيث يبدأ بقطعة صغيرة من الرموز الجينية التي تحمل تعليمات صنع البروتينات. وإذا اختير البروتين الفيروسي الصحيح للقاح، فسوف ينتج الجسم دفاعاته الخاصة ضد الفيروس.
تُنقَل المعلومات الجينية المرمزة في الحمض النووي الريبي المنقوص الأكسجين (DNA) إلى الحمض النووي الريبي المرسال (mRNA)، الذي يصبح أقرب إلى مخطط عمل لإنتاج البروتينات في خلايانا. خلال ثمانينيات القرن الماضي، بدأت تظهر أساليب فعالة لإنتاج الحمض النووي المرسال دون استزراع الخلايا. تحمل هذه العملية اسم النسخ المختبري (vitro transcription)، وقد أدت إلى تسريع تطوير تطبيقات علم الأحياء الجزيئي في مجالات مختلفة، لكن استخدام تكنولوجيات الحمض النووي الريبي المرسال في اللقاحات تعرض لعدة عوائق. فقد كان العديد من العلماء ينظرون إلى الحمض النووي الريبي المرسال المصنوع بالنسخ المختبري على أنه غير مستقر وصعب التوصيل، لأنه تطلَّب منهم تطوير أنظمة دهنية حاملة معقدة لتغليف الحمض النووي الريبي المرسال، إضافة إلى أنه أدى إلى بعض ردود الفعل الالتهابية المبكرة.
كرست كاريكو نفسها لفكرة استخدام الحمض النووي الريبي المرسال للقاحات وغيرها من الطرق العلاجية خلال التسعينيات عندما أصبحت زميلة لوايسمان. كان وايسمان مهتماً بالخلايا التغصّنية، وهي مهمة للمراقبة المناعية، وتحفيز الاستجابات المناعية التي يسببها اللقاح.
الاكتشاف الثوري
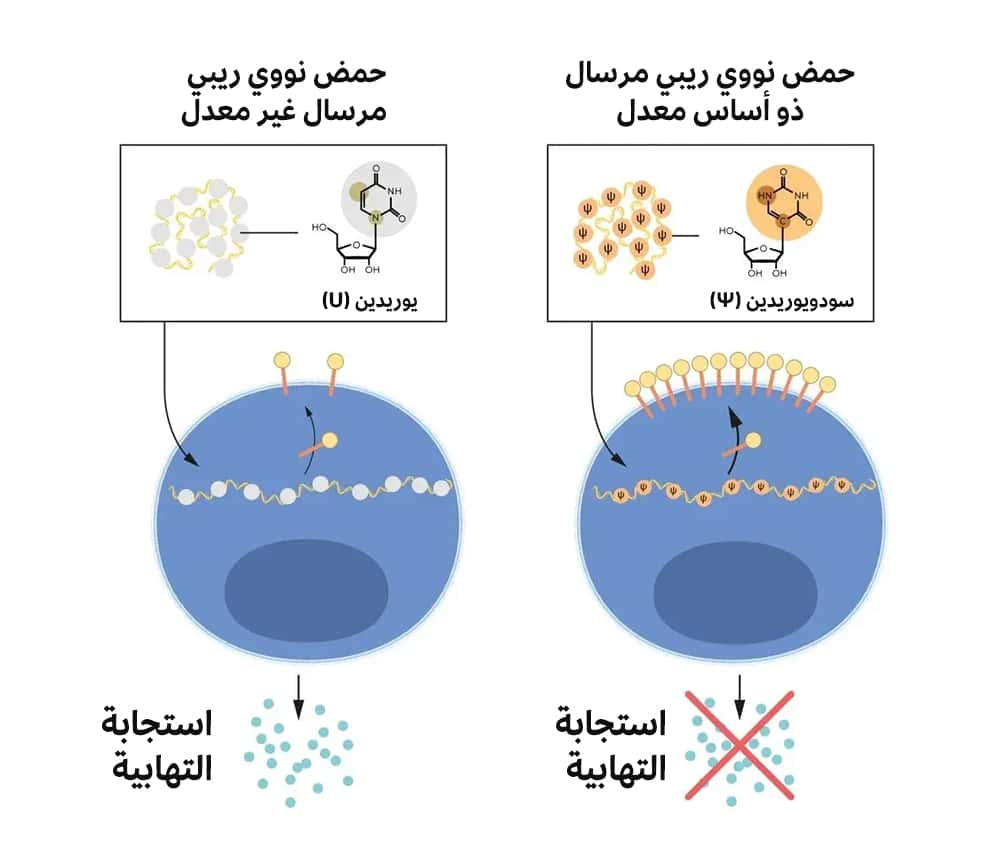
بدأ الاثنان يركزان على تفاعل أنواع الحمض النووي الريبي المختلفة مع النظام المناعي، ولاحظا أن الخلايا التغصّنية تميز الحمض النووي الريبي المرسال المصنوع بالنسخ المختبري على أنه مادة غريبة. وهو ما أدى إلى تفعيل هذه الخلايا، وإطلاق جزيئات محرضة على الالتهاب، على حين أن الحمض النووي الريبي المرسال من خلايا الثدييات لم يحرِّض ردَّ الفعل نفسه، وفقاً للجنة جائزة نوبل. ولهذا، يجب التمييز بين الأنواع المختلفة من الحمض النووي الريبي.
يحتوي الحمض النووي الريبي (RNA) على أربعة أسس تُرَمّز بالأحرف A وU وG وC. وتقابل هذه الأحرف أحرف الرموز الجينية في الـ دي إن أيه (DNA): A وT وG وC. أدرك الباحثان، كاريكو ووايسمان، أن أسس الحمض النووي الريبي في خلايا الثدييات تخضع في أغلب الأحيان لتعديلات كيميائية، على عكس الحمض النووي الريبي المصنوع بالنسخ المختبري. وتساءل الباحثان كثيراً عما إذا كان غياب الأسس المعدلة في الحمض النووي الريبي المرسال المصنوع بالنسخ المختبري يفسر ردود الفعل الالتهابية.
اقرأ أيضاً: هل ستكون لقاحات السرطان العلاج الشامل لأمراض المستقبل؟
وللتعمق في المسألة، ركّب الباحثان صيغاً مختلفة من الحمض النووي الريبي المرسال بتعديلات كيميائية فريدة في أسسها. وبعد ذلك، أوصلا هذه الأنواع إلى خلايا تغصنية، وكانت النتائج هائلة.
فقد اختفت الاستجابة الالتهابية على نحو شبه كامل عند إدخال تعديلات الأسس هذه في الحمض النووي الريبي المرسال. أدى هذا إلى إحداث تغيير جذري في الفهم العلمي لكيفية تمييز الخلايا للصيغ المختلفة من الحمض النووي الريبي المرسال واستجابتها لها. نشر الباحثان نتائجهما في 2005.
كوفيد-19 والمستقبل
بعد التوصل إلى هذا الاكتشاف، تزايد الاهتمام بتكنولوجيا الحمض النووي الريبي المرسال على نحو متسارع. في العام 2010، كانت عدة شركات تعمل على تطوير هذه الطريقة لاستخدامها مع فيروسات مثل فيروس زيكا وفيروس كورونا المرتبط بمتلازمة الشرق الأوسط التنفسية (MERS-CoV).
اقرأ أيضاً: ما هي ي اللقاحات ثنائية التأثير وما ميّزاتها؟
بعد ظهور جائحة كوفيد-19، عمل الباحثون بسرعة كبيرة على تطوير لقاحين يعتمدان على الحمض النووي الريبي المرسال ذي الأسس المعدلة لترميز البروتين السطحي لكورونا-سارس-2. وقد حصل لقاحان عاليا الفعالية على الموافقة في ديسمبر/ كانون الأول من العام 2020.
من أهم ميزات تكنولوجيا الحمض النووي الريبي المرسال إمكانية تصنيع اللقاحات بكميات فائقة الضخامة، نظراً إلى أن مكوناتها الأساسية تُصنَع في المختبرات، كما قال الخبير في الأمراض المعدية من جامعة إكستر، بارات بانكانيا، لوكالة أسوشيتد برس. يمكن استخدام تكنولوجيا الحمض النووي الريبي المرسال لتنقية لقاحات العديد من الأمراض، بما فيها الإيبولا والملاريا وحمى الضنك، إضافة إلى المساعدة على تحصين الأشخاص ضد أمراض المناعة الذاتية، مثل مرض الذئبة (lupus)، وحتى بعض أنواع السرطان.
سيتلقى الفائزان جائزتهما في الحفل الذي سيقام في 10 ديسمبر/ كانون الأول المقبل. مُنِحَت جائزة نوبل في الطب للعام 2022 لسفانتي بابو لكشفه تسلسل الجينوم عند النياندرتال. ومن الفائزين السابقين الآخرين كارل لاندشتاينر عام 1930 لاكتشاف فئات الدم البشرية، وقد كان ألكسندر فليمنغ أحد الفائزين في عام 1945 لاكتشافه البنسلين.

