في أربعينيات القرن العشرين، كان العلماء في المعهد الوطني للسرطان الذي كان حديثاً حينها يحاولون استيلاد الفئران التي يمكن أن تعزز فهمهم للسرطان، إما لأنها تصاب على نحو متوقع ببعض أنواعه وإما لأنها تتمتع بمقاومة مذهلة لهذا المرض.
اكتشف الفريق بطناً غريباً من الفئران التي تمتع بعضها بذيول قصيرة مفتولة وأضلاع في غير مكانها تنمو من عظام الرقبة. منذ ذلك الحين، استولد العلماء سلالة الفئران هذه، التي تحمل اسم "قصيرة الذيول"، مع الحفاظ على سماتها، على أمل أن تكشف الأبحاث يوماً ما سبب تشوهاتها.
بعد أكثر من 60 عاماً، كشف الباحثون أخيراً سر هذه السمات، عندما اكتشفت عالمة الأحياء التنموية التي عملت آنذاك في جامعة كاليفورنيا سان فرانسيسكو، ماريا بارنا، أن الفئران تتمتع بطفرة جينية تسببت باختفاء أحد بروتينات الجسيمات الريبية (الريبوزومات) لديها، وهي الجسيمات الخلوية التي تركّب البروتينات.
وفقاً لبارنا، كان هذا الاكتشاف مفاجئاً للغاية؛ إذ تقول: "توقع العلماء أن سبب التشوهات هو طفرة في جين يتحكّم بالنمو، وليس في جين يؤثر في بنية الجسيمات الريبية". الجسيمات الريبية متشابهة لدى الأحياء جميعها، وهي تبدو تحت المجهر وكأنها ملايين البقع المنتشرة في أنحاء الخلية، وتبدو عن قرب مثل رغيف خبز مقسوم إلى قسمين بحجمين غير متساويين. توجد هذه الجسيمات في كل خلية، واعتقد العلماء أنها تؤدي الدور نفسه في مختلف الأحياء، وهو ترجمة التعليمات الواردة من الحمض النووي (DNA) إلى بروتينات تؤدي أغلبية الوظائف في الخلية.
كيف يمكن لخلل في هذه الجسيمات الموثوقة والواسعة الانتشار التي تعمل بكثافة أن يغير مخطط جسم الفأر بهذه الطريقة المحددة والغريبة؟
بناء على نتائج مثل هذه، أصبح عدد متزايد من العلماء يعتقد أن الجسيمات الريبية تؤدي وظائف أخرى غير التي يعرفونها، وأن تباين هذه الجسيمات قد يؤدي وظائف بيولوجية أحياناً.
اقرأ أيضاً: ما هو موت الخلايا؟ وكيف يجدد الجسم نفسه؟
نشرت بارنا مكتشفاتها في مجلة سيل (Cell) عام 2011، وهي تعمل الآن في جامعة ستانفورد. منذ ذلك الحين، اكتشف الباحثون جينات أخرى عديدة ترمّز بروتينات في الجسيمات الريبية، مثل الجين في الفئران القصيرة الذيول، ويبدو أنها تُشوه النمو بطريقة محددة عندما تصبح طافرة.
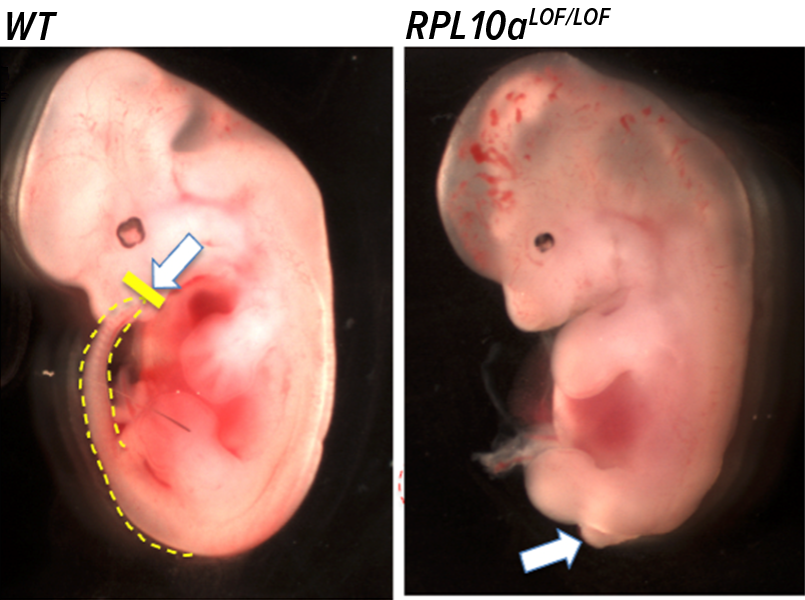
لاحظت بارنا أن أحد الفئران، والذي أثار اهتمامها أولاً، افتقر إلى القدرة على تركيب بروتين يحمل اسم آر بي إل 38 (RPL38) على النحو السليم. بينما لاحظت أن هناك فأراً آخر يتمتع بنسخة معيبة من بروتين يحمل اسم "آر بي إل 10 أيه" (RPL10A) أدت إلى تشوهات أشد وأكثر فتكاً. تقول بارنا: "بدت هذه الأجنة وكأن مقصلة قصّت مؤخراتها بعد الطرف الخلفي مباشرة".
جسيمات ريبية انتقائية
هناك أسباب أخرى جعلت الباحثين مندهشين من أن الجسيمات الريبية غير العادية تكمن وراء النمو غير العادي للفئران الطافرة. أولاً، عملية مراقبة الجودة التي تجريها الخلية على هذه الجسيمات محكمة، وبما أن الجسيمات المعيبة قد تركّب بروتينات معيبة ربما تتسبب بالكثير من الضرر، تميل الخلية إلى التخلص من هذه الجسيمات الريبية بسرعة. ثانياً، الأجنة التي تحمل طفرات في الجينات التي ترمّز البروتينات الريبوزومية تموت قبل نهاية الحمل.
مع ذلك، هناك استثناءات، وهي تظهر لدى البشر أيضاً. على سبيل المثال، يولد الأطفال الذين يعانون انعدام الطحال الخلقي المعزول دون طحال، غالباً بسبب طفرة في بروتين ريبوزومي واحد، على الرغم من أن بقية أجسامهم طبيعية تماماً. مجدداً، كيف يمكن أن يتسبب بروتين واحد مفقود أو غير اعتيادي في الجسيمات الريبية بذلك؟
اقرأ أيضاً: العلماء يكتشفون نظاماً جديداً لتعديل الجينات ينافس تقنية كريسبر
تعتقد بارنا أن الألفة هي السر. لا تتلقى الجسيمات الريبية تعليمات تركيب البروتينات مباشرة من الحمض النووي الضخم "الدنا" (DNA)، بل من جزيئات الحمض النووي الريبوزي الرسول (أو الرنا الرسول اختصاراً) الأكثر إيجازاً التي تحمل تعليمات حول جينات فردية. يتألف الحمض النووي الريبوزي "الرنا" من سلسلة طويلة تتكون من 4 وحدات بنيوية مختلفة، وترمّز كل 3 وحدات حمضاً أمينياً واحداً. يقرأ الجسيم الريبي هذه التعليمات ويربط الأحماض الأمينية معاً على النحو الصحيح لتركيب بروتين.
وفقاً لما يعرفه العلماء، تتحرك جزيئات الرنا الرسول حتى تصادف جسيماً ريبياً، وعندها فهي تنقل التعليمات لتركيب البروتين. لكن بارنا تعتقد أن الجسيمات الريبية المختلفة تتمتع بألفات مختلفة، وقد تكون أكثر كفاءة في ترجمة أنواع محددة من الرنا الرسول أكثر من غيرها، وقد اكتشفت أدلة تشير إلى ذلك.
على سبيل المثال، خلايا أجنة الفئران التي تتمتع بطفرة في جين آر بي إل 38 تركب كمية من البروتينات مطابقة لتلك التي تركبها الأجنة الأخرى، لكنها تركب كمية أقل بكثير من بعض البروتينات التي تؤدي دوراً بالغ الأهمية خلال مرحلة النمو. تحمل هذه البروتينات اسم "بروتينات العلبة المثلية" (homeobox proteins)، وهي تؤدي دوراً مهماً في نمو الجزء الخلفي من الجنين. اكتشفت بارنا أن الجسيمات الريبية التي تفتقر إلى بروتين آر بي إل 38 أقل عرضة للارتباط بالرنا الرسول الخاص بالعلبة المثلية وترجمته. يؤدي ذلك إلى نقص في هذه البروتينات المنظمة واضطراب نمو الفقرات والأضلاع والذيل.
على نحو مشابه، الجسيمات الريبية التي تفتقر إلى بروتين آر بي إل 10 أيه أقل عرضة للارتباط بالرنا الرسول الذي يرمّز مجموعة مهمة أخرى من بروتينات النمو الجنيني، والتي تؤدي أدواراً في مسار يحمل اسم "مسار إشارات دبليو إن تي" (Wnt signaling pathway). يؤدي انخفاض عدد هذه البروتينات البالغة الأهمية إلى توقّف عملية النمو على نحو فجائي بعد نمو الطرف الخلفي، ما يعطي الانطباع بأن الطرف الخلفي مقطوع.
تقول بارنا إنه في حين أن بعض الاضطرابات الوراثية المتعلقة بالبروتينات الريبوزومية يبدو ناجماً عن أنشطة الجسيمات الريبية غير العادية، فإن البعض الآخر قد ينتج عن نقص في الجسيمات الريبية ناجم عن الرقابة الصارمة على الجودة في الخلية. متلازمة تريتشر كولينز، التي تتسبب بتشوهات في الوجه، ومتلازمة شواخمان-دايموند، التي تتسبب بنمو غير طبيعي للهيكل العظمي، هما على الأرجح من الأمثلة على ذلك.
هاتان المتلازمتان ناجمتان عن عيوب، لكن تجادل بارنا أن الاختلافات في بنية الجسيمات الريبية وتركيبها قد تكون وظيفية؛ إذ تقول: "اكتشفنا أن بعض البروتينات الريبوزومية تظهر بتواتر أكبر في بعض أنواع الخلايا مقارنة بغيرها، مثل تلك التي تظهر في العصبونات أكثر من خلايا الأمعاء". تشير النتائج الحديثة من مختبر بارنا إلى احتمالية وجود أنواع مختلفة من الجسيمات الريبية داخل الخلية نفسها، تتخصص في تركيب بروتينات محددة.
تقول بارنا إن الجسيمات الريبية "تبدو أنها تحتوي على أنوية غير متغيّرة، بينما تحتوي أغلفتها الخارجية على بروتينات قد تختلف داخل الخلايا والأنسجة ومن خلايا أو أنسجة إلى أخرى". تعتقد بارنا أن ذلك يوفّر للجسم طريقة أخرى لتنظيم البروتينات التي يركبها ومواقع تركيبها.
خميرة مالحة
جمع مؤتمر دام يومين في نوفمبر/تشرين الثاني 2023 في لندن، وشاركت بارنا في تنظيمه، العديد من العلماء الذين أثارت اهتمامهم الاختلافات التي اكتشفوها في الجسيمات الريبية التي درسوها، والوظائف التي تؤديها هذه الاختلافات، إن وجدت.
يعتقد بعض العلماء أن الجسيمات الريبية غير العادية لا تؤدي أي وظيفة بخلاف التسبب بأضرار. تشير عالمة الكيمياء الحيوية في جامعة فاندربيلت، كاترين كاربشتاين، التي شاركت في تأليف مقال حول مراقبة جودة الجسيمات الريبية نشرته مجلة المراجعة السنوية لعلم أحياء الخلية وعلم الأحياء التنموي (Annual Review of Cell and Developmental Biology) عام 2024، إلى أن أغلبية الأمثلة المعروفة عن الجسيمات الريبية المتباينة تتسبب بالاضطرابات أو الأمراض. تقول كاربشتاين: "ثبت أن القليل من هذه الجسيمات الريبية يؤدي أدواراً مفيدة للكائن الحي، وذلك إن أدى هذه الأدوار في المقام الأول".
تعتقد كاربشتاين أن أغلبية الاضطرابات الوراثية المرتبطة بالجينات الريبوزومية ناجمة على الأرجح عن حالات النقص في الجسيمات الريبية التي تحدث عندما تتخلص الخلية من الجسيمات الريبية المعيبة، بدلاً من أن تكون ناجمة عن أي خاصية مميزة للجسيمات الريبية غير العادية نفسها. تقول كاربشتاين إن العيوب المحددة التي تصيب البشر والفئران قد تكون ناجمة عن أن تبعات نقص الجسيمات الريبية أخطر في بعض أنواع الخلايا مقارنة بأنواع أخرى.
مع ذلك، أشارت كاربشتاين في حديثها خلال المؤتمر السابق الذكر إلى اكتشاف توصلت إليه عند دراسة خلايا الخميرة فاجأها؛ لأنه بيّن أن أحد الجسيمات الريبية غير العادية كان مفيداً. عندما تنمو خلايا الخميرة في أوساط ذات تركيزات عالية جداً من الملح، يفقد نحو نصف الجسيمات الريبية فيها البروتين الريبوزومي آر بي إس 26 (Rps26). اكتشفت كاربشتاين أن الجسيمات الريبية التي تفتقر إلى هذا البروتين مختلفة؛ إذ إنها تبدو أكثر ميلاً لترجمة جزيئات الرنا الرسول التي تركبها الخلية استجابة لعامل الضغط المتمثل في التركيزات المرتفعة للملح.
لاحظت كاربشتاين وفريقها أن خلايا الخميرة اكتسبت مقاومة للمستويات المرتفعة من الملوحة عند إزالة بروتينات آر بي إس 26 منها. تقول كاربشتاين: "في الواقع، نمت هذه الخلايا على نحو أفضل في ظروف الملوحة المرتفعة".
اكتشفت كاربشتاين أيضاً أن الخميرة تستجيب بسرعة للإجهاد الملحي؛ إذ إنها تزيل بروتينات آر بي إس 26 بسرعة من الجسيمات الريبية عند الحاجة وتعيدها مجدداً عند زوال عامل الضغط.
اقرأ أيضاً: بشرى سارة للمصابين بحساسية الخميرة: علماء يصنعون عجينة بيتزا خالية من الخميرة
جسيمات ريبية مقاومة
لا تتألف الجسيمات الريبية من البروتينات فقط؛ إذ يتألف نحو نصف بنيتها من الحمض النووي الريبوزي. بالإضافة إلى ذلك، تتمتع حقيقيات النوى (الأحياء ذات الخلايا المعقدة مثل البشر) بكمية كبيرة من الحمض النووي الريبوزي الإضافي الذي يبرز من الجسيمات الريبية، مثل لوامس شقائق النعمان البحرية. تقول بارنا: "نعتقد أن هذه الوفرة تمثّل آلية لحصر الرنا الرسول".
يؤدي الرنا الريبوزومي أيضاً الوظيفة الأهم والأقدم داخل الجسيمات الريبية، وهي عملية ترجمة الحمض النووي الريبوزي الرسول المذهلة الكفاءة إلى بروتينات. تقول عالمة الأحياء البنيوية في معهد وايزمان للعلوم، آدا يونات، التي فازت بجائزة نوبل بالشراكة عام 2009 لقاء أبحاثها حول بنية الجسيم الريبي، إن الرنا الريبوزومي هو الذي ركّب البروتينات الأولى على الأرجح.
تشير يونات إلى أن الجيوب في جزيئات الرنا الريبوزومي، حيث ترتبط الأحماض الأمينية لتشكيل البروتينات، متشابهة باختلاف الأنواع، وهي لا تعتقد أن هذا محض صدفة. تقول يونات: "نعتقد أن هذا هو الجسيم الريبي الأولي الذي تطورت منه الجسيمات الريبية".
ركز الباحثون في معظم دراساتهم حول الجسيمات الريبية على هذه المنطقة الجوهرية المنظمة التي تقرأ فيها الخلية الرنا الرسول وترتبط فيها الأحماض الأمينية، ولم يدرسوا أطراف الجسيمات الريبية بالقدر نفسه. بالإضافة إلى ذلك، ولّدت الطرق التي اتبعها الباحثون لدراسة بنية الجسيمات الريبية انطباعاً مؤثراً بأن هذه الجسيمات جميعها متشابهة. لكنّ طرقاً جديدة للدراسة كشفت عن وجود المزيد من التباينات.
تقول يونات إنها ترغب في الاطلاع على المزيد من الأدلة التي تبين أن الاختلافات بين الجسيمات الريبية قد تكون مفيدة، ويتعاون مختبرها حالياً مع بارنا وغيرها لاكتشاف إن كان للجسيمات الريبية التي تفتقر إلى بروتينات محددة، أو بعض الجسيمات الريبية غير العادية، بنى ثلاثية الأبعاد مختلفة قد تفسّر آلية عملها المختلفة.
اهتمت يونات منذ زمن بالاختلافات بين الجسيمات الريبية للأنواع المختلفة، وتقول إنها قد تكون مفيدة في تطوير المضادات الحيوية التي تستهدف الجسيمات الريبية لمسببات الأمراض ولا تتسبب بضرر كبير لخلايا البشر والميكروبات المفيدة التي تعيش في أجسامهم. تضيف يونات: "تستهدف نسبة تتجاوز 40% من المضادات الحيوية المفيدة سريرياً عملية تركيب البروتين، غالباً من خلال شلّ حركة الجسيم الريبي".
تصف يونات تجاربها مع الشركات الدوائية بشأن الأهداف الجديدة المحتملة التي كشفتها بأنها مخيبة للآمال؛ إذ تضيف قائلة: "قال خبراء هذه الشركات إن البكتيريا ستكتسب مقاومة للمضادات الحيوية هذه". وبالفعل، كان التباين الريبوزومي مفيداً في أحد الأمثلة، ولكن للمرض وليس للبشر؛ إذ قد تفضّل المضادات الحيوية التي تستهدف الجسيمات الريبية البكتيرية بقاء البكتيريا التي تتمتع بجسيمات ريبية مختلفة قليلاً ولم يعد المضاد الحيوي قادراً على تثبيطها.
اقرأ أيضاً: اكتشاف جينات بشرية قد تساعد على علاج السرطان
انقسام معزِّز
هناك مجال طبي آخر قد يكون التباين في الجسيمات الريبية فيه مفيداً، وهو علاج السرطان وتشخيصه. تقول يونات، التي يعمل مختبرها في هذا المجال أيضاً، إن نحو 25% من أنواع السرطان مرتبطة بتغيرات جينية في بروتينات ريبوزومية.
يقول عالم الأحياء الجزيئية في جامعة كاليفورنيا سان فرانسيسكو والرائد في الأبحاث التي تهدف لفهم هذه الاختلافات والاستفادة منها، دافِيد روجيرو: "تستغل الخلايا السرطانية مكونات الخلية التي تطورت لتؤدي وظائف أخرى، وتستخدمها لصالحها"، ويشمل ذلك زيادة نشاط الجسيمات الريبية. تحتاج الخلايا السرطانية التي تنقسم بسرعة إلى كمية كبيرة من البروتينات لتبقى حية.
وتبين الدراسات أيضاً أن الجسم يستطيع تركيب كميات كبيرة من بعض أنواع البروتينات خلال فترة نمو الأورام، أو عندما تنتشر الخلايا السرطانية عبر الجسم، وتضطر للبقاء في الدم ومناطق أخرى لم تصل إليها من قبل.
تشمل هذه البروتينات عوامل النمو وبروتينات أخرى معروفة بأنها تزيد خطر الإصابة بالسرطان، واكتشف روجيرو وفريقه أن جزيئات الرنا الرسول التي ترمّز هذه البروتينات تتمتع بمعدل ترجمة أكبر في الخلايا السرطانية. يقول روجيرو: "يجب أن تكون الخلايا العادية دقيقة جداً في تنظيم هذه البروتينات، بينما تفعل الخلايا السرطانية العكس".
اكتشف روجيرو وبارنا أدلة تبين أن البروتين الريبوزومي آر بي إل 24 يؤدي دوراً في هذه العملية؛ إذ إن الزيادة في تركيب البروتينات اللازمة لتكاثر الخلايا لا تحدث عندما يختفي من الجسيمات الريبية للفئران. يقول روجيرو: "أعتقد أننا سنتمكن من تعزيز كفاءة علاجات السرطان كلما فهمنا هذه الديناميكية أكثر".
لا تزال علاجات السرطان التي تستهدف الجسيمات الريبية المتباينة بصورة خاصة بعيدة المنال حالياً، لكن ثمة منتجات استخدمها الأطباء في العيادات تشير إلى أنها قد تكون مفيدة. يستهدف بعض هذه العلاجات البوليميراز 1، وهو إنزيم يؤدي دوراً في تركيب الرنا الريبوزومي ويتمتع بنشاط مفرط عادة في الخلايا السرطانية. ألهمت أبحاث روجيرو أيضاً تطوير أدوية تجريبية تثبط بروتينات تحمل اسم "عوامل بدء الترجمة"، وتؤثر في احتمالية ترجمة الرنا الرسول في الجسيمات الريبية. تستخدم الخلايا جميعها هذه البروتينات، لكن بعض الخلايا السرطانية يعتمد عليها بشدة.
يقيّم الباحثون حالياً أحد هذه العلاجات ضمن 3 دراسات في المرحلة السريرية الثانية؛ بهدف اختبار فعاليته وسلامته في علاج سرطان الثدي وبطانة الرحم والمبيض.
لم يكتشف الباحثون بعد أي أدلة تبين أن الاختلافات في الجسيمات الريبية نفسها قد تفيد في تعزيز فعالية العلاجات، لكن الباحثين مثل بارنا وروجيرو يعتقدون أن هذه الأبحاث حول الاختلافات هي من الأبحاث التي تشير إلى أن دراسة التباين الريبوزومي يستحق الجهد، على الرغم من تشكيك المشككين. تقول يونات، التي واجهت أبحاثها الأولية التشكيك أيضاً: "بحثت في الجسيمات الريبية على مدى نحو نصف قرن، ولم يعد هناك شيء يدهشني. مع ذلك، أتوقّع أن يحرز العلماء تقدماً طبياً كبيراً نتيجة التوصل إلى فهم أعمق لعملية الترجمة".