بدأت سامانثا غانديل تعاني من نوبات الصرع عندما كان عمرها 4 أشهر فقط، وبحلول عيد ميلادها الأول كانت تتناول مزيجاً من 3 أدوية مضادة للاختلاج مختلفة. وقعت سامانثا في حلقة مفرغة من الالتهاب الرئوي المتكرر الذي حفّزه استنشاق الطعام الذي تتقيؤه بسبب نوبات الصرع، ما أجبرها على التردد إلى المستشفى بالقرب من منزلها في مقاطعة ويستشيستر في ولاية نيويورك.
سرعان ما أكد الفحص الوراثي شكوك أطبائها، واتّضح أن سامانثا التي بلغت من العمر حينها 4 أعوام تعاني من متلازمة تحمل اسم متلازمة درافت (Dravet syndrome)، وهي شكل غير قابل للعلاج من الصرع. يعاني دماغ سامانثا خللاً وظيفياً بسبب طفرة تختلف عن الطفرات التي تتسبب بمعظم الأمراض الوراثية، وتنتمي هذه الطفرة إلى فئة فشل الأطباء لزمن طويل في محاولات علاجها. يمكن أن تساعد الأدوية المتاحة على التخفيف من شدة الأعراض، لكن ليس هناك ما يمكن أن يعالج السبب الجذري لهذا المرض.
يعود ذلك إلى أن الطفرة المسؤولة عن متلازمة درافت تسبب ظاهرة تحمل اسم نقص المورثات المفردة (haploinsufficiency)، إذ يمرض الإنسان إذا كانت لديه نسخة واحدة فعّالة فقط من مورثة محددة. لا تستطيع هذه المورثة الوحيدة تركيب ما يكفي من البروتين لتؤدي وظيفتها الجزيئية، يعني ذلك في حالة متلازمة درافت اضطراب الإشارات الكهربائية بين الخلايا العصبية، ما يؤدي إلى تشكل موجات الصدمة العصبونيّة التي تتسبب بالنوبات.
لا ينطبق هذا الكلام على معظم المورثات. على الرغم من أن الجينوم البشري يحتوي على نسختين من كل مورثة تقريباً إحداها موروثة من الأم والأخرى من الأب، يمكن للجسم عموماً أن يؤدي وظائفه دون أي مشكلات بغياب إحداها، لكن هذا الكلام لا يصح بالنسبة لمورثات مثل إس سي إن 1 أيه (SCN1A)، وهي من المورثات الرئيسية المسؤولة عن متلازمة درافت. يتطلب الأداء الوظيفي السليم لهذه المورثة ومئات المورثات الأخرى المعروفة والشبيهة بها توازناً دقيقاً في النشاط الجزيئي؛ فانخفاض النشاط مضر، وكذلك الأمر بالنسبة لازدياده في أغلب الحالات.
يفسّر هذا التوازن الدقيق جزئياً عدم ملاءمة استراتيجيات المعالجة الوراثية التقليدية لتصحيح الطفرة المسؤولة عن نقص المورثات المفردة. يتوفر العديد من هذه العلاجات اليوم، ويجب فيها أن تتجاوز كمية البروتين التي تركبها المورثة المُدخلة إلى الجسم حداً أدنى لإلغاء أثر المرض كي تعالج الأمراض الوراثية “المتنحية” مثل الاضطراب الدموي الذي يحمل اسم ثالاسيميا بيتا (beta thalassemia ) وأحد أنواع فقدان البصر الموروث.
اقرأ أيضاً: العلاج بالوهم: شركة أميركية تحتال على ضحايا الأمراض المزمنة
لا ضير في أن تكون المورثة المضافة مفرطة النشاط في هذه السياقات؛ إذ يوجد حد أدنى مطلوب من مستويات البروتين العلاجي، ولكن لا يوجد حد أعلى. وفقاً لغوبي شانكر (Gopi Shanker)، الذي شغل منصب كبير الموظفين العلميين في شركة تيفارد بايوساينسز (Tevard Biosciences) في مدينة كامبريدج في ولاية ماساتشوستس الأميركية حتى وقت سابق من عام 2023، لا يصح هذا الكلام في العديد من الأمراض التي تتأثر بالجرعة مثل متلازمة درافت، وخصوصاً في حالات الاضطرابات الدماغية التي يمكن أن يؤدي فيها ارتفاع نسب البروتين إلى زيادة النشاط العصبوني للخلايا. يقول شانكر: “هذا ما يجعل علاج هذا المرض أصعب”.
ما يزيد من تعقيد المشكلة هو أن الأنواع الخاصة من الفيروسات المعدّلة التي تُستخدم لنقل المورثات العلاجية إلى الخلايا البشرية يمكن أن تحمل كمية محدودة من الحمض النووي الإضافي فقط، والمورثات المسؤولة عن متلازمة درافت والعديد من اضطرابات نقص المورثات المفردة ذات الصلة أكبر حجماً بكثير من أن توضع داخل مَركبات التوصيل هذه.
اهتمام متجدّد
تجاهل قطاع التكنولوجيا الحيوية ظاهرة نقص المورثات المفردة لفترة طويلة نتيجة لهذه العقبات التقنية والجزيئية، وتنافست الشركات على تطوير أدوية للأمراض الوراثية النادرة الأخرى لأكثر من 30 عاماً، مثل التليّف الكيسي أو الهيموفيليا (النزف الوراثي)، لكن لم تحظ الحالات مثل متلازمة درافت بالاهتمام. تقول المؤسِّسة الشريكة وكبيرة الموظفين العلميين في شركة ريغل ثيرابيوتكس (Regel Therapeutics) في مدينة بيركلي في ولاية كاليفورنيا ومدينة بوسطن، نافنيت ماثارو (Navneet Matharu): “متلازمة درافت واحدة من أكثر فئات الاضطراب إهمالاً”.
ولكن هذا لن يستمر. نتيجة للتوصل إلى أفكار علاجية جديدة وفهم أعمق للآليات المرضية، تسعى كل من شركتَي ريغل وتيفارد بالإضافة إلى مجموعة من الشركات الناشئة الأخرى إلى علاج متلازمة درافت؛ إذ إنها ستطبق علاجات تجريبية وتكنولوجيات تدّعي أنها ستمثّل حقل تجارب بهدف استهداف أمراض نقص المورثات المفردة على نطاق أوسع.
يقول طبيب أعصاب الأطفال في مستشفى مونتريال للأطفال، كينيث مايرز (Kenneth Myers)، الذي كتب مقالاً عن العلاجات الناشئة لمتلازمة درافت وأنواع الصرع الورثية المشابهة في إصدار عام 2022 من المراجعة السنوية لعلم الأدوية والسموم، إنه لا يوجد الكثير من الخيارات العلاجية التي يمكن منحها للمصابين بهذه الأمراض حالياً، بخلاف الأدوية التي تساعد على التحكم بالأعراض. يضيف مايرز قائلاً إن “هناك الكثير من الأسباب التي تدفع للتفاؤل”، وذلك بفضل التقدمات الجديدة التي أُحرزت.
على سبيل المثال، يبدو أن المرض الذي تعاني منها سامانثا تحت السيطرة حالياً نتيجة تناول دواء يحمل اسم إس تي كيه-001 (STK-001)، وهو أول دواء يُختبر سريرياً ويتعامل مع السبب الجذري لملازمة درافت.
أدخل الأطباء في الفترة بين فبراير/ شباط وأبريل/ نيسان 2022 إبرة طويلة في الجزء السفلي من عمود سامانثا الفقري 3 مرات، وحقنوا العلاج التجريبي المصمم لزيادة مستويات البروتين الناقل للصوديوم الذي يسبب نقصه متلازمة درافت. يبدو أن هذا العلاج فعّال. وعاشت سامانثا فترة من دون الإصابة بأي نوبة تقريباً. يفترض أن هذا يعود إلى أن ارتفاع نسب البروتين السابق الذكر أدى إلى موازنة الاضطرابات الكهربائية في دماغ سامانثا.
استراتيجيات المعالجة الوراثية التقليدية غير ملائمة لتصحيح الطفرة المسؤولة عن نقص المورثات المفردة.
انخفض معدل نوبات الصرع لدى ساماثنا من نوبة كل 7-10 أيام في المتوسط إلى صفر نوبة لأشهر متتالية. بالإضافة إلى ذلك، تحسّنت مهاراتها اللفظية وقدراتها الجسدية، وتحسّنت مشيتها بعد الخضوع للعلاج أيضاً، واختفى عرض الارتعاش الذي كانت تعاني منه.
في النهاية، زال مفعول العلاج وبدأت حالة سامانثا بالتراجع، وعانت من النوبات كل أسبوعين أو نحو ذلك. لكنها بدأت بتلقي جرعات إضافية من دواء إس تي كيه-001 بموجب بروتوكول تجريبي جديد في شهر أكتوبر/ تشرين الأول 2022، ولم تشهد منذ ذلك الحين سوى نوبتي صرع على مدى 6 أشهر. تقول والدة سامانثا، جيني بارناو: “هذا الدواء مذهل بحق، وعلى الرغم من أنه ليس علاجاً، فإنه أفضل خيار متوفر لدينا دون شك. هناك بالتأكيد جانب إيجابي لهذا الدواء؛ إذ إن دماغ سامانثا يعمل على نحو أفضل ببساطة”.
اقرأ أيضاً: مركب يقضي على مجموعة أمراض البصر المستعصية وأبرزها العمى
زيادة مرحب بها
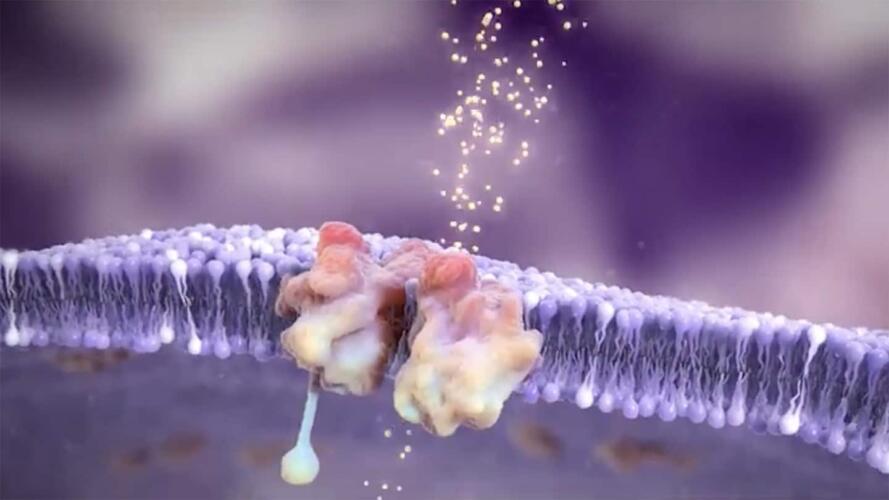
تعتمد آلية دواء إس تي كيه-001 العلاجية على حقيقة أن النشاط الطبيعي للمورثات غير فعّال ومهدر للطاقة نوعاً ما. تتطلب السلاسل الناتجة عن عملية فك تشفير المورثات التي تهدف إلى تركيب الحمض النووي الريبي المرسال (أو الرنا المرسال) المزيد من التقطيع والوصل بعد عملية فك التشفير لتصبح جاهزة لأداء وظيفتها بصفتها شيفرات لتركيب البروتينات. ولكن هذه العملية ليست دقيقة عادة، ولا تنتج بروتينات صالحة فعّالة.
وهنا يدخل دواء إس تي كيه-001 المعادلة.
يعتبر هذا الدواء واحداً من العلاجات التي تحمل اسم العلاجات العكسية لاتجاه النسخ، وهو يتألف من قطع اصطناعية قصيرة من الرنا مصممة خصيصاً للالتصاق بجزء من نسخة مورثة إس سي إن 1 أيه، ما يزيد كفاءة العملية الإنتاجية لقطع السلاسل ووصلها. تلتصق القطع الاصطناعية على الرنا المرسال المتشكّل من النسخة الوحيدة الفعّالة من المورثة الموجودة في أجسام المصابين بمتلازمة درافت، وتسهم في ضمان إزالة الأجزاء غير المرغوب فيها من سلسلة الرنا المرسال، تماماً كما يزيل محرر الأفلام المشاهد التي تؤثّر سلباً في قصة الفيلم. بالنتيجة، تُركّب المزيد من بروتينات القناة الأيونية ذات القدرة الوظيفية الأكبر.
لا تعود مستويات البروتين إلى طبيعتها تماماً. وفقاً للدراسات التي أجريت على الفئران، يتسبب هذا العلاج بازدياد كمية بروتين قناة الصوديوم في الدماغ بنسبة 50-60% (وليس تضاعفاً كاملاً)، مع ذلك يبدو أن هذه الزيادة توثّر بالفعل في حياة المرضى.
الشركة التي طوّرت دواء إس تي كيه-001 مقرّها بلدة بيدفورد في ولاية ماساتشوستس الأميركية، وتحمل اسم ستوك ثيرابيوتكس (Stoke Therapeutics)، وقد أبلغت في الاجتماع السنوي لجمعية الصرع الأميركية لعام 2022 عن أن 20 من أول 27 مريضاً مصاباً بمتلازمة درافت تلقّوا جرعات متعددة من العلاج في التجارب المبكرة شهدوا انخفاضاً في وتيرة النوبات. لوحظت أبرز التأثيرات الإيجابية بين الأطفال الصغار مثل سامانثا، الذين عانت أدمغتهم من أضرار أقل مقارنة بمن عانوا من النوبات المنهكة والتراجع الوظيفي للخلايا لسنوات. من المقرر أن تبدأ التجارب التأكيدية الأوسع التي قد تؤدي إلى الموافقة على تسويق هذا الدواء في عام 2024.
ليست شركة ستوك ثيرابيوتكس الوحيدة التي تسعى لعلاج متلازمة درافت واضطرابات نقص المورثات المفردة عموماً، ويقترب عدد من الشركات الناشئة الأخرى في مجال التكنولوجيا الحيوية من إجراء تجارب سريرية تتضمّن نُهُجها التكنولوجية الخاصة التي تهدف إلى تعزيز النشاط الوراثي للمورثات. على سبيل المثال، ستبدأ شركة إنكوديد ثيرابيوتكس (Encoded Therapeutics) قريباً بإدراج المشاركين في تجربة خاصة لاختبار علاج متلازمة درافت التجريبي الذي طورته، ويحمل اسم إي تي إكس-001 (ETX-001)، وهو يعتمد على استخدام فيروس مُعدَّل وراثياً لإيصال بروتين يزيد من النشاط الوراثي للمورثة إس سي إن 1 أيه حتى تصبح قادرة على تركيب عدد أكبر بكثير من نسخ الرنا المرسال.
اقرأ أيضاً: أكثر الأمراض العقلية شيوعاً: التمثيل الغذائي يتنبأ بحالات الاكتئاب الشديد
وفقاً لطبيب الأعصاب في مستشفى لانغون هيلث التابع لجامعة ولاية نيويورك، أورين ديفينسكي (Orrin Devinsky)، الذي يعمل مع العديد من الشركات ويشارك في رعاية سامانثا، إذا نجحت أي من هذه الشركات في معالجة متلازمة درافت فسيكون من الممكن تعديل تكنولوجياتها لمعالجة أي مرض مشابه: “قد توفر المعاجلة الفعّالة أساساً محتملاً للتعامل مع حالات نقص المورثات المفردة الأخرى”. تعمل الشركات المختلفة على تطوير مجموعة متنوعة من الطرق لمعالجة متلازمة درافت.

أساليب جديدة للتعامل مع أهداف جديدة
ستختبر شركة ستوك ثيرابيوتكس هذه الفكرة قريباً.
طوّرت هذه الشركة دواءً مرشحاً آخر بناء على النجاح الأولي لدواء إس تي كيه-001. يحمل الدواء الجديد اسم إس تي كيه-002 ويستهدف عملية وصل سلاسل الرنا المرسال أيضاً لتحويل المورثات غير المنتجة إلى نسخ فعّالة، ولكنه مصمم لمعالجة اضطراب بصري وراثي يحمل اسم الضمور البصري الجسدي السائد، الذي ينجم عن نقص المورثات المفردة لمورثة تحمل اسم أو بي أيه 1 (OPA1). عند الإصابة بهذا المرض، يتسبب وجود نسخة فعّالة واحدة فقط من هذه المورثة بتراجع في كفاءة إرسال الإشارات العصبية من العينين إلى الدماغ.
يُفترض أن تبدأ التجارب السريرية على دواء إس تي كيه-002 في عام 2024. في الوقت نفسه، تجري شركة ستوك ثيرابيوتكس بالتعاون مع شركة أكاديا فارماسوتيكالز (Acadia Pharmaceuticals) التي مقرها مدينة سان دييغو الأميركية الأبحاث لتطوير علاجات لمتلازمة ريت (Rett syndrome) واضطراب يحمل اسم الإعاقة الذهنية المرتبطة ببروتين إس واي إن جي أيه بي 1، كلاهما من اضطرابات الدماغ الحادة الناجمة عن انخفاض مستويات البروتين.
“هناك بالتأكيد جانب إيجابي لهذا الدواء؛ إذ إن دماغ سامانثا يعمل على نحو أفضل ببساطة”.
جيني بيرناو
استلهمت شركة ستوك ثيرابيوتكس نهج تعديل عملية وصل الرنا المرسال من نجاح علاج آخر من العلاجات العكسية لاتجاه النسخ، وهو سبينرازا (Spinraza). طوّرت شركة أيونيس فارماسوتيكالز (Ionis Pharmaceuticals) هذا العلاج بالتعاون مع شركة بايوجين (Biogen)، وهو يعمل أيضاً على تعديل عملية وصل نُسخ الرنا المرسال لزيادة معدل تركيب بروتين مفقود. أصبح سبينرازا أول علاج يُعتمد لمعالجة اضطراب عصبي عضلي نادر يحمل اسم ضمور العضلات الشوكي في عام 2016، لكن هذا الاضطراب مختلف نوعاً ما؛ إذ إنه لا ينتج عن نقص المورثات المفردة، بل يحدث عندما تكون نسختا المورثة معطلتين، وليس نسخة واحدة فقط. مع ذلك، يعتبر هذا المرض غريباً من وجهة نظر علم الوراثة.
نتيجة لميزة خاصة في الجينوم البشري، اتضح أن البشر يمتلكون مورثة يمكن اعتبارها احتياطية نوعاً ما ولا تؤدي أي وظيفة في الحالة الطبيعية لأن الرنا المرسال الذي تركّبه يخضع لعملية وصل تحتوي على أخطاء. يؤدي العلاج سبينرازا دور دليل يوجّه عملية وصل الرنا المرسال، ما يمكّن من تحويل هذه المورثة الاحتياطية إلى مورثة فعّالة تؤدي وظيفة النسختين المعطّلتين.
ينتج عدد قليل من الأمراض عن مشكلات وراثية مشابهة، لكن المؤسسَين الشريكين العلميين في شركة ستوك ثيرابيوتكس، عالم الوراثة الجزيئية أدريان كرينر (Adrian Krainer) من مختبر كولد سبرينغ هاربور في مدينة نيويورك (الذي أسهم في تطوير علاج سبينرازا) والباحثة التي أشرف عليها كرينر في مرحلة ما بعد الدكتوراة، إيزابيل أزناريز (Isabel Aznarez)، أدركا أن هناك عدداً هائلاً من الأمراض الأخرى الناجمة عن نقص المورثات المفردة التي يمكن استخدام آلية تعديل عملية وصل الرنا المرسال لمعالجتها.
كان علاج سبينرازا نموذجاً أولياً، وتطوّر شركة ستوك ثيرابيوتكس العديد من إصدارات الجيل التالي. تقول أزناريز، التي تعمل حالياً مديرة قسم أبحاث الاكتشاف في شركة ستوك ثيرابيوتكس: “ما فعلناه هو أننا نقلنا هذه الآلية العلاجية إلى مستوى أعلى”.
اقرأ أيضاً: دراسة تربط بين تناول أدوية الربو الشائعة وتأثيرات على المادة الدماغية
تحقيق التوازن
ركّز الباحثون الذين عملوا على علاج متلازمة درافت على علاجات استبدال المورثات سابقاً. هدف هؤلاء إلى إدخال نسخة عاملة من مورثة إس سي إن 1 أيه في فيروس ثم إدخال هذه الفيروس المعدل وراثياً في خلايا الدماغ. لكن واجه الباحثون العديد من المشكلات.
أولاً، المركبات الفيروسية المستخدمة عموماً في طرق العلاج الوراثي (الفيروسات المرتبطة بالفيروسات الغدية) أصغر من أن تحمل أحرف الحمض النووي البالغ عددها 6,030 حرفاً التي تشكل التسلسل الوراثي لمورثة إس سي إن 1 أيه.
حاول الباحثون تطبيق عدد من الحلول المحتملة لهذه المشكلة. على سبيل المثال، قسمت الباحثة المختصة في المعالجة الوراثية في كلية لندن الجامعية، راجفيندر كاردا (Rajvinder Karda) وزملاؤها مورثة إس سي إن 1 أيه إلى نصفين حقنوهما في الفئران باستخدام ناقلات فيروسية مختلفة. وحاول عالم الأعصاب في جامعة تورنتو، ديفيد هامبسون (David Hampson)، وفريقه إدخال مورثة أصغر حجماً تتناسب مع حجم فيروس ناقل واحد من الفيروسات المرتبطة بالفيروسات الغدية، وتعويض النقص في كمية المورثة إس سي إن 1 أيه بطريقة غير مباشرة.
لكن لم تُستكمل هذه الاختبارات بعد التجارب التي أجريت على الفئران. بيّن باحثون في جامعة نافارا في إسبانيا أنه من الممكن تقنياً توصيل هذه المورثة بالكامل إلى خلايا الفئران باستخدام أنواع أخرى من النواقل الفيروسية، لكن تعتبر هذه الفيروسات غير آمنة للاستخدام على البشر عموماً.
يقول العلماء إنه للحصول على الكمية المثالية من البروتين، يفضّل اتباع الآليات التي تتبعها الخلايا.
بالإضافة إلى ذلك، حتى لو أمكن تطبيق طريقة استبدال المورثات، هناك العديد من الأسباب التي تدفع العلماء للاعتقاد أن هذه الطريقة لن تكون مثالية لمعالجة الأمراض مثل متلازمة درافت التي يتسبب فيها الاضطراب في مستويات البروتين بالخلل الرئيسي. يمكن أن تكون كمية البروتينات الناجمة عن هذا النوع من المعالجات الوراثية عشوائية، ولا يمكن التنبؤ بأنواع الخلايا التي ستركّب البروتينات.
يقول العلماء إنه للحصول على الكمية المثالية من البروتين، يفضّل اتباع الآليات التي تتبعها الخلايا والاستفادة من الطرق التي تنتج فيها البروتينات المستهدَفة بشكلٍ طبيعي في بعض النسج الجسدية، ثم تحفيز هذه العملية من خلال المعالجة.
اقرأ أيضاً: باحثون يطورون عدسة مجهر خاصة ترصد نمو الخلايا السرطانية
على سبيل المثال، تستخدم شركة سي أيه إم بي 4 ثيرابيوتكس (CAMP4 Therapeutics) العلاجات العكسية لاتجاه النسخ أيضاً. ولكن بدلاً من استهداف عملية نسخ المورثات، تستهدف الأدوية التي تطورها هذه الشركة الجزيئات التنظيمية التي تؤدي دور المقاومات الكهربائية المتغيّرة وتتحكم في عدد النسخ التي تُركّب في المقام الأول. تدّعي هذه الشركة أنها تستطيع زيادة نشاط المورثات المستهدفة بدقة وبطريقة قابلة للضبط من خلال تثبيط الجزيئات التنظيمية المختلفة أو موازنة نشاطها.
يقول الرئيس والمدير التنفيذي لشركة سي أيه إم بي 4 التي مقرها مدينة كامبريدج في ولاية ماساتشوستس الأميركية، جوش ماندل بريم (Josh Mandel-Brehm): “ما نفعله بشكلٍ أساسي هو تدريب الجسم على تركيب البروتينات بجودة أعلى قليلاً”.
من الناحية النظرية، يمكن أن تلغي تكنولوجيا كريسبر (CRISPR) لتعديل المورثات الحاجة إلى كل هذه الأساليب العلاجية. يُتيح لنا تعديل المورثات تصحيح الأخطاء في المورثات بشكل كامل، أي أن الباحثين قد يتمكنون من تعديل التسلسل الخاطئ في الحمض النووي لتصحيحه وعلاج الأطفال المصابين بمتلازمة درافت أو أي مرض آخر ناجم عن نقص المورثات المفردة تماماً.
لكن سيستغرق تطوير هذه التكنولوجيا الكثير من الوقت (لم تظهر العلاجات الأولى المعتمدة على هذه التكنولوجيا التي اختُبرت على الأطفال آثاراً إيجابية كبيرة). بالإضافة إلى ذلك، يجب أن يُصمم علاج تصحيح المورثات وفقاً للطبيعة الفريدة للطفرات الخاصة بالمريض، وهناك أكثر من 1,200 طفرة تتسبب بمتلازمة درافت يمكن أن تحدث في مورثة إس سي إن 1 أيه وحدها.
لهذا السبب، يُفضّل عالم أحياء الحمض النووي الريبي في جامعة جونز هوبكنز وأحد المؤسسين العلميين المشاركين لشركة تيفارد، جيف كولر (Jeff Coller)، الاستراتيجيات العلاجية التي يمكن أن تعالج جميع أنواع التغيرات المسببة للأمراض التي قد تطرأ على المورثة المستهدفة، كما تفعل أغلبية الشركات الآن. يقول كولر: “تطوير تكنولوجيا لا تعتمد على نوع الطفرة هو طريقة لمعالجة مجموعة كاملة من المرضى.
“نحن منفتحون على أي نهج يمكن أن يحسّن صحة ابنتينا”.
دانييل فيشر
تتعامل شركة تيفارد، التي تهدف إلى “عكس” متلازمة درافت (حتى إن اسم الشركة بالإنجليزية هو اسم المتلازمة مكتوب بالعكس)، مع هذه التحدي بطرق مختلفة. يتضمن بعض هذه الطرق استخدام نسخ معدّلة وراثياً من أنواع أخرى من الرنا تُعتبر ضرورية لتركيب البروتين، يحمل أحد هذه الأنواع اسم الحمض النووي الريبوزي الناقل (أو الرنا الناقل)، وهو يساعد على نقل الأحماض الأمينية التي تُعتبر أساسات تركيب البروتين إلى سلال البروتين النامية، في حين تهدف طرق أخرى إلى إيصال الجزيئات التنظيمية المفيدة إلى مواقع نشاط المورثة إس سي إن 1 أيه.
اقرأ أيضاً: ما هي العلاقة الجينية بين فيروس الإنفلونزا العادي وفيروس إنفلونزا 1918 القاتل؟
لن يُختبر أي علاج محتمل تطوره هذه الشركة سريرياً قبل عام على الأقل، بينما يخضع دواء إس تي كيه-001 للتجارب البشرية حالياً. لهذا السبب، يفكّر الرئيس التنفيذي للشركة، دانييل فيشر (Daniel Fischer)، الذي لديه ابنة مصابة بمتلازمة درافت كما هو حال رئيس مجلس الإدارة والمؤسس الشريك، وارن لاميرت (Warren Lammert)، في إشراك ابنته البالغة من العمر 13 عاماً في تجارب شركة ستوك ثيرابيوتكس بدلاً من انتظار أن تثمر جهود شركته.
قال فيشر خلال مأدبة غداء في نوفمبر/ تشرين الثاني 2022 في مقر الشركة: “نحن منفتحون على أي نهج يمكن أن يحسّن صحة ابنتينا، ويساعد المصابين بمتلازمة درافت عموماً. نرغب في أن ينجح العديد من الطرق العلاجية”.
